
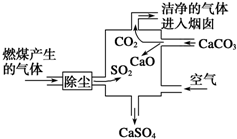
| A. | 进入烟囱的气体为混合物 | |
| B. | 此过程中硫元素的化合价没有发生改变 | |
| C. | 使用此废气处理装置可减少酸雨的形成 | |
| D. | 整个过程的反应可表示为2SO2+2CaCO3+O2═2CaSO4+2CO2 |
分析 进入烟囱的气体含有二氧化碳、二氧化硫等气体,其中二氧化硫与氧化钙、氧气反应生成硫酸钙,可减少二氧化硫的排放,有利于减少酸雨,剩余的二氧化碳可直接排放的空气中,整个过程的反应可表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2,以此解答该题.
解答 解:A.煤中含有硫,燃烧生成二氧化碳、二氧化硫,则进入烟囱的气体含有二氧化碳、二氧化硫等气体,为混合物,故A正确;
B.二氧化硫生成硫酸钙,硫元素化合价升高,被氧化,故B错误;
C.二氧化硫与氧化钙、氧气反应生成硫酸钙,可减少二氧化硫的排放,有利于减少酸雨,故C正确;
D.二氧化硫与氧化钙、氧气反应生成硫酸钙,反映的化学方程式可以表示为:2SO2+2CaCO3+O2═2CaSO4+2CO2,故D正确;
故选B.
点评 本题考查化学环境污染的治理,为高频考点,题目难度不大,侧重化学与环境的考查,有利于培养学生良好的科学素养,提高学习的积极性,树立环保意识.


科目:高中化学 来源: 题型:选择题

| A. | 形成产物C和D的化学键所放出的总能量高于断开反应物A和B的化学键所吸收的总能量 | |
| B. | 该反应只有在加热条件下才能进行 | |
| C. | 反应物的总能量高于产物的总能量 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②④ | C. | ②③④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 需要加热才能发生的反应一定是吸热反应 | |
| B. | C(石墨)=C(金刚石)△H>0,则石墨比金刚石稳定 | |
| C. | H2(g)+F2(g)=2HF(g);△H1=-270kJ/mol,则1个氢气分子与1个氟气分子反应生成2个氟化氢气体分子放出270热量 | |
| D. | S(s)+O2(g)=SO2(g);△H1,S(g)+O2(g)=SO2(g);△H2,△H1>△H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com