

分析 I.(1)该反应中Cr元素化合价由+6价变为+3价,得电子化合价降低的反应物是氧化剂;
(2)反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,得电子的化合价降低的反应物是氧化剂、失电子化合价升高的反应物是还原剂,其转移电子总数为6,根据转移电子相等、原子守恒书写方程式;
II.(3)因为水解反应吸热,故“微热”可以促进Fe3+水解生成Fe(OH)3而除去;
(4)趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出;
(5)酸化后Cr2O72-可被SO32-还原成Cr3+,SO32-变为SO42-,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;酸C为H2SO4是为保证最后得到纯净的硫酸钠;根据Cr3+完全沉淀(c≤1.0×10-5 mol•L-1)时pH为5,得c(H+)═10-5 mol/L,c(OH-)=10-9 mol•L-1,然后将数据代入溶度积常数Ksp[Cr(OH)3]=(Cr3+)•c3(OH-)计算;
(6)如果氢氧化钠过量,氢离子浓度减少平衡H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,平衡逆向移动,Cr(OH)3会溶解.
解答 解:I.(1)该反应中Cr元素化合价由+6价变为+3价,得电子化合价降低的反应物是氧化剂,故答案为:氧化剂;
(2)该反应中Cr元素化合价由+6价变为+3价,C2H5OH中C元素化合价由-2价变为-1价,转移电子总数为6,根据转移电子相等知,CrO3的计量数是2,C2H5OH的计量数是3,再结合原子守恒配平方程式为2CrO3+3C2H5OH+3H2SO4=Cr2(SO4)3+3CH3CHO+6H2O,
故答案为:3C2H5OH+2CrO3+3H2SO4═3CH3CHO+Cr2(SO4)3+6H2O;
II.(3)因为水解反应吸热,故“微热”除能加快反应速率外,同时还可以促进Fe3+水解生成Fe(OH)3而除去,滤渣A为Fe(OH)3,故答案为:促进Fe3+水解生成Fe(OH)3而除去,Fe(OH)3;
(4)根据如图2溶解度(S)~温度(T)曲线,操作B的最佳方法为 先将混合溶液蒸发浓缩,趁热过滤,趁热过滤的目的是有利于硫酸钠结晶析出,可以防止Na2Cr2O7•2H2O结晶析出,故答案为:A;
(5)酸化后Cr2O72-可被SO32-还原成Cr3+,SO32-变为SO42-,离子方程式为3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;为保证最后得到纯净的硫酸钠,酸C为H2SO4,根据Cr3+完全沉淀(c≤1.0×10-5 mol•L-1)时pH为5,则c(H+)=10-5 mol/L,c(OH-)=10-9 mol•L-1,则Cr(OH)3的溶度积常数Ksp[Cr(OH)3]=(Cr3+)•c3(OH-)=1.0×10-32mol4•L-4,故答案为:3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;H2SO4;1.0×10-32mol4•L-4;
(6)如果氢氧化钠过量,氢离子浓度减少平衡H++CrO2-(亮绿色)+H2O?Cr(OH)3(s)?Cr3+(紫色)+3OH-,平衡逆向移动,Cr(OH)3会溶解,故答案为:加入NaOH使上述平衡逆移,使Cr(OH)3+OH-=CrO2-+2H2O.
点评 本题综合考查了化学平衡原理、氧化还原反应、离子方程式的书写、沉淀溶解平衡和Ksp的有关计算等内容,侧重于反应原理的应用的考查,分析时要根据题给信息,结合相关原理进行解答,题目难度中等.


 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案科目:高中化学 来源: 题型:选择题
| A. | NaHSO4无论在水溶液或熔融状态下都可以电离出Na+、H+和SO42- | |
| B. | NaCl溶液能导电是因为溶液中有自由移动的Na+和Cl- | |
| C. | H2SO4在电流作用下在水中电离出H+和SO42- | |
| D. | 液态HCl,固态NaCl均不导电,所以HCl、NaCl都不是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 乙烷(乙烯) | 酸性高锰酸钾 | 洗气 |
| C | 乙酸乙酯(乙酸) | NaOH溶液 | 蒸馏 |
| D | 溴苯(液溴) | NaOH溶液 | 渗析 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的说法中不正确的是( )
的说法中不正确的是( )| A. | 所有的碳原子在同一个平面上 | B. | 能发生水解但不能发生消去反应 | ||
| C. | 能与AgNO3溶液生成浅黄色沉淀 | D. | 能够发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 $→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O
$→_{△}^{浓硫酸}$HOOCCH=CHCOOH+H2O +2NaHCO3→
+2NaHCO3→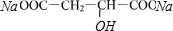 +2H2O+2CO2↑
+2H2O+2CO2↑ ,
, (或
(或 ).
).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com