
分析 根据盖斯定律将三个化学方程式进行处理得到FeO(s)+CO(g)═Fe(s)+CO2(g)的焓变即可.
解答 解:由①×3-②-③×2得:6FeO(s)+6CO(g)═6Fe(s)+6CO2(g) ④
再由④÷6得:FeO(s)+CO(g)═Fe(s)+CO2(g),
故△H=$\frac{3△{H}_{1}-△{H}_{2}-2△{H}_{3}}{6}$=$\frac{3×(-26.7)-(-50.75)-2×(-36.5)}{6}$kJ•mol-1=+7.28 kJ•mol-1,故答案为:+7.28 kJ•mol-1.
点评 本题考查了利用盖斯定律进行反应热的计算,题目难度不大,注意利用盖斯定律对已知热化学方程式进行加合计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
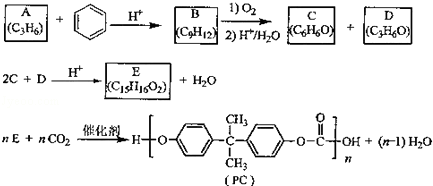
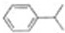 .
.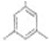 (写出结构简式).
(写出结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为喷泉实验装置图.
如图为喷泉实验装置图.| 实验编号 | A溶液颜色 | B溶液颜色 | A溶液中溶质 |
| ① | 无色 | 红色 | 酚酞 |
| ② | 黄色 | 红褐色浑浊 | Fe3+(FeCl3等) |
| ③ | 紫色 | 蓝色 | 石蕊 |
| ④ | 无色 | 乳白色浑浊 | Al3+或Mg2+(AlCl3、MgCl2等) |
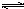 NH3•H2O
NH3•H2O NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.
NH4++OH-,溶液呈碱性,遇酚酞显红色.实验②反应的离子方程式为Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
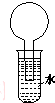 如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )
如图所示的装置是某次实验最初的情况(夹持装置省略),烧瓶内盛有等体积的甲烷和Cl2,用光照射烧瓶一段时间,下列说法正确的是( )| A. | 只能生成CH3Cl一种有机物 | B. | 烧瓶内液面不可能上升 | ||
| C. | 大试管内的液体可能会分层 | D. | 向水中加入石蕊试液后变红 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Z)=0.45mol/L | B. | c(X2)=0.3mol/L c(Z)=0.1 mol/L | ||
| C. | c(X2)=0.5mol/L | D. | c(Y2)=0.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可用CCl4萃取碘酒中的碘 | |
| B. | 做焰色反应实验时,透过蓝色钴玻璃,观察到火焰颜色为紫色,证明被检验物为一定为钾盐 | |
| C. | 不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上2%~5%的硼酸溶液 | |
| D. | 室温下,浓度为0.1mol•L-1Na2S2O3和H2SO4溶液,分别取5mL与10mL混合,10mL与10mL混合,可验证Na2S2O3浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向银氨溶液中加入盐酸:[Ag(NH3)2]++OH-+3H+=Ag++2NH4++H2O | |
| B. | 在少量Mg(OH)2悬浊液中加入氯化铵浓溶液:Mg(OH)2+2NH4+=2NH3•H2O+Mg2+ | |
| C. | 向硫酸铁溶液中加入硫化钠溶液:2Fe3++3S2-+6H2O=2Fe(OH)3↓+3H2S↑ | |
| D. | NaHCO3溶液和少量Ba(OH)2溶液混合:HCO3-+OH-+Ba2+=H2O+BaCO3↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com