
【题目】镁、铝及其化合物在生产生活中具有重要的应用.回答下列问题:
(1)工业上冶炼金属镁是采用惰性电极电解熔融MgCl2的方法,此时阴极的电极反应式为:;
(2)除去MgCl2溶液中的Fe2+ , 常加入少量H2O2 , 使Fe2+氧化为Fe3+ , 然后加入少量碱性物质至溶液pH=4,此时c(Fe3+)=mol/L[已知Fe(OH)3的Ksp=4×10﹣38]
(3)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,关于为什么不采用电解熔融AlCl3的方法的叙述正确的是(选择填空):
A.AlCl3是非电解质
B.AlCl3水溶液不导电
C.AlCl3是共价化合物
D.AlCl3熔点太高
(4)用碳棒做电极电解熔融Al2O3时,阳极需要定期更换,其原因是(用电极反应式和化学方程式回答);
(5)已知:Al2O3(熔融,l)=2Al(s)+ ![]() O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
O2(g)△H=1600KJmol﹣1工业上利用惰性电极电解熔融Al2O3冶炼铝,每消耗1000kJ电能时,生成27gAl,则电解过程中能量利用率为 .
(6)明矾的化学式为KAl(SO4)212H2O,它可以作为净水剂,用离子方程式表示其能够净水的原因;向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时,溶液的pH7(填>、<、=);
(7)若在空气中加热固体MgCl26H2O,可水解生成Mg(OH)Cl,写出相关的化学方程式 , 所以,为了抑制MgCl26H2O在加热时水解,可在干燥的气流中加热,可得到无水氯化镁.
【答案】
(1)Mg2++2e﹣=Mg
(2)4×10﹣8
(3)C
(4)2O2﹣﹣4e﹣=O2;C+O2 ![]() CO2或2C+O2
CO2或2C+O2 ![]() 2CO
2CO
(5)80%
(6)Al3++3H2O ![]() Al(OH)3(胶体)+3H+;>
Al(OH)3(胶体)+3H+;>
(7)MgCl2?6H2O ![]() Mg(OH)Cl+HCl↑+5H2O↑;HCl
Mg(OH)Cl+HCl↑+5H2O↑;HCl
【解析】解:(1)电解熔融MgCl2可得到金属镁,镁离子在阴极放电,电极反应方程式为:Mg2++2e﹣=Mg,所以答案是:Mg2++2e﹣=Mg;(2)除去MgCl2溶液中的Fe2+ , 常加入少量H2O2 , 使Fe2+氧化为Fe3+ , 然后加入少量碱性物质至溶液pH=4,c(H+)=10﹣4mol/L,c(OH﹣)= ![]() =10﹣10mol/L,此时c(Fe3+)=
=10﹣10mol/L,此时c(Fe3+)= ![]() =
= ![]() =4×10﹣8 , 所以答案是:4×10﹣8;(3)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,不采用电解熔融AlCl3的方法是因为氯化铝是共价化合物,固体熔融会升华,不能得到阴阳离子,不能发生电解反应得到金属铝,氯化铝溶于水完全电离属于电解质,所以答案是:C;(4)碳棒做电极电解熔融氧化铝,阳极上氧离子失电子发生氧化反应生成氧气,电极反应为:2O2﹣﹣4e﹣=O2 , 在冶炼过程中,阳极材料碳被氧气氧化成一氧化碳,反应为C+O2
=4×10﹣8 , 所以答案是:4×10﹣8;(3)工业上冶炼金属铝则是采用惰性电极电解熔融Al2O3的方法,不采用电解熔融AlCl3的方法是因为氯化铝是共价化合物,固体熔融会升华,不能得到阴阳离子,不能发生电解反应得到金属铝,氯化铝溶于水完全电离属于电解质,所以答案是:C;(4)碳棒做电极电解熔融氧化铝,阳极上氧离子失电子发生氧化反应生成氧气,电极反应为:2O2﹣﹣4e﹣=O2 , 在冶炼过程中,阳极材料碳被氧气氧化成一氧化碳,反应为C+O2 ![]() CO2或2C+O2
CO2或2C+O2 ![]() 2CO,所以需定期地进行更换,所以答案是:2O2﹣﹣4e﹣=O2 , C+O2
2CO,所以需定期地进行更换,所以答案是:2O2﹣﹣4e﹣=O2 , C+O2 ![]() CO2或2C+O2
CO2或2C+O2 ![]() 2CO;(5)由Al2O3(熔融1)=2Al(s)+
2CO;(5)由Al2O3(熔融1)=2Al(s)+ ![]() O2(g)△H=+1600kJmol﹣1 , 则生成27gAl即1mol时要吸收
O2(g)△H=+1600kJmol﹣1 , 则生成27gAl即1mol时要吸收 ![]() =800KJ的热量,所以电解过程中能量利用率为
=800KJ的热量,所以电解过程中能量利用率为 ![]() ×100%=80%,所以答案是:80%;(6)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,氢氧化铝具有净水作用,即Al3++3H2O
×100%=80%,所以答案是:80%;(6)明矾溶于水发生水解,铝离子水解生成氢氧化铝和硫酸,氢氧化铝具有净水作用,即Al3++3H2O ![]() Al(OH)3(胶体)+3H+ , 向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时硫酸铝钾和氢氧化钡物质的量之比等于1:2反应生成硫酸钡沉淀、偏铝酸钾和水;偏铝酸钾溶液中水解溶液显碱性,溶液PH>7,所以答案是:Al3++3H2O
Al(OH)3(胶体)+3H+ , 向明矾溶液中逐滴加入Ba(OH)2溶液至硫酸根离子刚好沉淀完全时硫酸铝钾和氢氧化钡物质的量之比等于1:2反应生成硫酸钡沉淀、偏铝酸钾和水;偏铝酸钾溶液中水解溶液显碱性,溶液PH>7,所以答案是:Al3++3H2O ![]() Al(OH)3(胶体)+3H+ , >;(7)若在空气中加热MgCl26H2O,可生成Mg(OH)Cl或MgO,依据原子守恒书写化学方程式为:MgCl26H2O
Al(OH)3(胶体)+3H+ , >;(7)若在空气中加热MgCl26H2O,可生成Mg(OH)Cl或MgO,依据原子守恒书写化学方程式为:MgCl26H2O ![]() Mg(OH)Cl+HCl↑+5H2O↑;氯化镁水解显酸性,氯化氢气流中加热防止水解,HCl气流可抑制Mg2+水解;所以答案是:MgCl26HO
Mg(OH)Cl+HCl↑+5H2O↑;氯化镁水解显酸性,氯化氢气流中加热防止水解,HCl气流可抑制Mg2+水解;所以答案是:MgCl26HO ![]() Mg(OH)Cl+HCl↑+5H2O↑;HCl;
Mg(OH)Cl+HCl↑+5H2O↑;HCl;


科目:高中化学 来源: 题型:
【题目】关于胶体和溶液的叙述中正确的是
A. 胶体带电荷,而溶液呈电中性
B. 胶体粒子的直径大小在1-100纳米之间
C. 胶体加入电解质可产生沉淀,而溶液不能
D. 从颜色上无法区别FeCl3溶液和Fe((OH)3胶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关判断正确的是( )
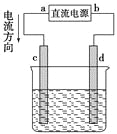
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某容器中发生一个化学反应,反应过程中存在H2O、ClO-、CN-、HCO3-、N2、Cl-六种离子。在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示。下列有关判断中不正确的是

A.还原剂是含CN-的物质,氧化产物不只有N2
B.氧化剂是ClO-,还原产物是HCO3-
C.参与反应的氧化剂与还原剂的物质的量之比为5:2
D.标准状况下若生成2.24LN2则转移电子为1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如右图所示,由此确定,原溶液中含有的阳离子是:
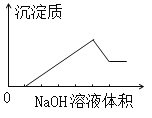
A. Mg2+、Al3+、Fe2+ B. H+、Mg2+、Al3+
C. H+、Ba2+、Al3+ D. 只有Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于分类的知识说法错误的是
A. 分类法是学习和研究化学物质及化学变化的一种科学方法
B. 常见的分类方法有交叉分类法和树形分类法
C. 对于相同的分类对象,采用的分类标准不同,分类的结果也不同
D. 初中的化学知识告诉我们,化学反应可以分为化合反应和分解反应两大类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值,下列说法正确的是
A. 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.1NA
B. 0.1mol H2 和0.1molI2 于密闭容器中充分反应后,其分子总数为0.2NA
C. 常温下,1L pH=1的H2SO4溶液中的H+数目为0.2NA
D. 标准状况下,2.24 L苯所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
(1)A分别与B、C形成的最简单化合物中,稳定性 > (用分子式表示),其中A与B形成的最简单化合物分子的空间构型为 ;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为 。
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是 ;
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈 性(填“酸”、“碱”或“中”),用离子方程式解释原因 ;
(5)写出实验室制取单质E的离子方程式是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com