
下列各组离子因发生氧化还原反应而不能大量共存的是( )
A.Cl-、NO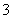 、Fe2+、H+
、Fe2+、H+
B.Ag+、NO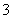 、Cl-、SO
、Cl-、SO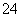
C.K+、Ba2+、OH-、SO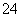
D.Cu2+、NH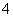 、Br-、OH-
、Br-、OH-
科目:高中化学 来源: 题型:
如图所示,组成一个原电池。

(1)当电解质溶液为稀硫酸时。
①Fe电极是 (填“正”或“负”)极,其电极反应式为______________,
该反应是 (填“氧化”或“还原”)反应。
②Cu电极是 极,其电极反应式为________________________________,
该反应是 反应。
(2)当电解质溶液为浓硝酸时。
①Fe电极是 极,该反应是 反应;
②Cu电极是 极,其电极反应式为 ,该反应是 反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
有关氨的说法中不正确的是( )
A.NH3是4核10电子的分子,具有还原性
B.NH3极易溶于水,可做喷泉实验,氨气易液化,液氨可用做制冷剂
C.氨气是非电解质,氨水是电解质
D.蘸有浓盐酸的玻璃棒遇氨气可产生白烟
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室常用热的NaOH溶液洗去试管壁上沾有的硫黄,其反应如下:6NaOH+3S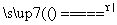 2Na2S+Na2SO3+3H2O,在此反应中硫表现的性质是( )
2Na2S+Na2SO3+3H2O,在此反应中硫表现的性质是( )
A.氧化性
B.还原性
C.既无氧化性又无还原性
D.既有氧化性又有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
为了证明铁和硫反应产物中铁的化合价,下面是某同学设计的实验过程的一部分:
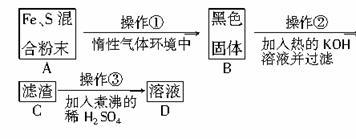
请回答以下提出的问题:
(1)混合粉末A中硫粉过量的原因是________________________________________
_____________________________________________________________________;
(2)反应在“惰性气体环境”中进行的原因是________________________________;
(3)操作①是用烧热的玻璃棒点触混合粉末,反应即可持续进行,说明___________
________________________;
(4)操作②的作用是____________________________________________________,
反应方程式是___________________________________________________________
______________,也可改用________;
(5)操作③稀H2SO4煮沸的目的是__________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
将7 g某铜、银合金与足量的a mol·L-1 HNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56 L混合,通入水中恰好完全吸收,则此合金中铜的质量是( )
A.1.6 g B.2.4 g
C.3.2 g D.4.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
分子的相对质量为M,化学式为A的物质(不含结晶水),在温度t1℃时,用W g水配制成饱和溶液,该溶液中若按物质的量计算,A占a %,问:
(1)t1℃时该物质的溶解度为若干?
(2)当温度降至t2℃时,析出A·n H2O结晶多少克?(已知t2℃时每克水中能溶解S g该物质)。
(3)t2℃时,剩余溶液的溶质质量分数为若干?
(4)若A是Na2CO3,将t2 = 373 K,W = 180g,a % = 6.96 %,t2 = 393 K,S = 0.22,n = 10,分别代入(1)、(2)、(3)题所得关系式中得到什么结果?
查看答案和解析>>
科目:高中化学 来源: 题型:
利用下列试剂,选用合适方法鉴别Na2SO4、Na2SO3、Na2CO3、NaCl四种溶液,最佳试剂组是( )
A.BaCl2、HCl、品红溶液 B.BaCl2、HCl、石蕊试液
C.AgNO3和HNO3溶液 D.AgNO3和BaCl2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为________而存在于土壤中。处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g) △H K ①
已知:N2(g)+3H2(g)=2NH3(g) △H1=-92.4kJ·mol-1 K1 ②
2H2(g) +O2(g) =2H2O(l) △H2=-571.6kJ·mol-1 K2 ③
则△H =________;K=___________(用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3h,实验数据见下表:
| 序号 | 第一组 | 第二组 | 第三组 | 第四组 |
| t/℃ | 30 | 40 | 50 | 80 |
| NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 |
下列能说明反应①达到平衡状态的是_____(填字母)。
a.NH3和O2的物质的量之比为4∶3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为___________;第四组反应中以NH3表示的反应速率是__________________,与前三组相比,NH3生成量最小的原因可能是__________________________________________。
(3)美国化学家发明一种新型催化剂可以在常温下合成氨,将其附着在电池的正负极上实现氮的电化学固定,其装置示意图如下:
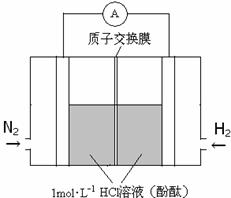
则开始阶段正极反应式为_____________;忽略电解过程中溶液体积变化,当电池中阴极区溶液pH = 7时,溶液中NH3·H2O的浓度为___________( Kb=2×10-5mol·L-1);当电池中阴极区呈红色时,溶液中离子浓度由大到小的顺序为_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com