
【题目】如图是某反应的微观示意图,下列有关说法不正确的是

A. 生成的物质都是氧化物
B. 反应前后原子的种类不变
C. 该反应的基本类型属于置换反应
D. 反应方程式为2H2S+3O2 ![]() 2SO2+2H2O
2SO2+2H2O
【答案】C
【解析】
根据反应过程图中的分子结构,判断反应物与生成物,确定该反应中各分子个数比和反应的化学方程式,进而由反应特征确定反应类型,据此分析解答。
由图示可知反应前后存在相同的分子,故该图示可转化为如图的反应图示: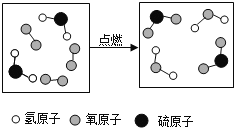 ,依据反应前后物质的分子结构可知反应物是氧气和硫化氢,生成物是水和二氧化硫,则反应方程式为2H2S+3O2
,依据反应前后物质的分子结构可知反应物是氧气和硫化氢,生成物是水和二氧化硫,则反应方程式为2H2S+3O2 ![]() 2SO2+2H2O;A、根据化学方程式可知生成物是水和二氧化硫,因此都属于氧化物,选项A正确;B、由图示或化学方程式可知,化学反应前后原子的种类不变,选项B正确;C、置换反应要求反应物生成物均是一种单质与一种化合物,而该反应的生成物是两种化合物,所以不是置换反应,选项C不正确;D、依据反应前后物质的分子结构可知反应物是氧气和硫化氢,生成物是水和二氧化硫,则反应方程式为2H2S+3O2
2SO2+2H2O;A、根据化学方程式可知生成物是水和二氧化硫,因此都属于氧化物,选项A正确;B、由图示或化学方程式可知,化学反应前后原子的种类不变,选项B正确;C、置换反应要求反应物生成物均是一种单质与一种化合物,而该反应的生成物是两种化合物,所以不是置换反应,选项C不正确;D、依据反应前后物质的分子结构可知反应物是氧气和硫化氢,生成物是水和二氧化硫,则反应方程式为2H2S+3O2 ![]() 2SO2+2H2O,选项D正确;答案选C。
2SO2+2H2O,选项D正确;答案选C。


 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】如图1是细胞中化合物含量的扇形图,图2是有活性的细胞中元素含量的柱形图,下列说法不正确的是( )

A. 若图1表示细胞鲜重,则A、B化合物依次是H2O、蛋白质
B. 若图2表示组成人体细胞的元素含量,则a、b、c依次是O、C、H
C. 地壳与活细胞中含量最多的元素都是a,因此说明生物界与非生物界具有统一性
D. 若图1表示细胞完全脱水后化合物的含量,则A化合物具有多样性,其中含的元素为C、H、O、N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是细胞内三类生物大分子的组成及功能图示如下,请据图回答:

(1)组成细胞的元素大多以_________的形式存在。元素X、Y依次是________。
(2)若物质M可被甲基绿吡罗红染色剂染成绿色,则M的中文名称叫______________。
(3)由D加N构成的结构或生物有____________(写出两项即可)。
(4)若B是葡萄糖,那么在植物细胞中特有的E有________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有六种短周期元素,已知A的单质是最清洁的能源物质,其他元素的原子半径及主要化合价如下表:
元素代号 | B | C | D | E | F |
原子半径/nm | 0.186 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +1 | +3 | +6、-2 | +7、-1 | -2 |
根据上述信息回答以下问题。
(1)D在元素周期表中的位置______________;E的离子结构示意图______________。
(2)关于A元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,试分析其理由________________________________。
(3)用电子式表示B的单质与D的单质形成化合物的过程________________________。
(4)下列各项比较,正确的是________________________。
①氢化物的沸点:D低于F ②A~F元素的简单离子半径:C的最大
③气态氢化物稳定性:D比E稳定 ④最高价氧化物对应的水化物碱性:B小于C
(5)E单质常用于自来水消毒。用必要的文字和离子方程式解释原因______________________________________________________________。
(6)写出C的单质与B的最高价氧化物的水化物反应的离子方程式________________。
(7)C的单质与元素M的红棕色氧化物N反应可用于焊接钢轨,该反应的化学方程式为________________________________。
(8)已知单质M的燃烧热为375kJ/mol,写出表示其燃烧热的热化学方程式___________________________。
(9)已知NH3结合质子的能力强于F的氢化物,请用最恰当的离子方程式证明这个结论________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常温常压下,48g O2和O3的混合气体中含有氧原子数为3NA
B. 17 g氨气所含质子数目为11NA
C. 标准状况下22.4L的四氯化碳,含有四氯化碳分子数为NA
D. 物质的量浓度为0.5 mol·L-1的MgCl2溶液中,含有Cl-个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某学习小组做Na2O2与H2O反应的实验,发现一些有趣的现象:
①取适量Na2O2固体用脱脂棉包好放在石棉网上,然后向脱脂棉上滴加3-4滴水,结果脱脂棉剧烈燃烧。
②取适量Na2O2固体置于试管中,加水使其充分反应至不再产生气体为止,滴入几滴酚酞试液,溶液先变红后褪色。回答有关问题。
(1)写出Na2O2的电子式_______________________。
(2)已知Na2O2可看作二元弱酸H2O2对应的盐,其第一步水解完全进行。写出其第一步水解的离子方程式为___________________________________。
(3)由①实验现象所得出的有关结论是:a.有氧气生成;b.___________________。
(4)Na2O2与H2O反应的离子方程式____________________________________。
II.为探究Na2O2与H2O反应的机理,他们在老师的指导下设计了下图所示装置。连接好装置,打开K1、K2,通过注射器注入适量蒸馏水,充分反应后用气球鼓气,Na2S溶液变浑浊,酸性KMnO4溶液褪色。分别取A、C中溶液滴入几滴酚酞,开始都变红,以后A中溶液很快褪色,C中溶液缓慢褪色。另取A、C中溶液分别加入少量二氧化锰,充分振荡,发现均反应剧烈、产生大量气泡,把带火星的木条伸入试管,木条复燃,向反应后的溶液中滴入几滴酚酞试液,溶液变红不褪色。
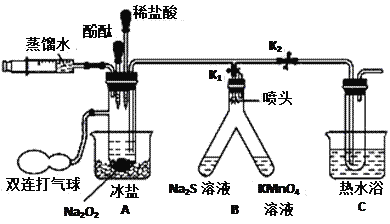
(5)A中冰盐和C中热水的作用分别是__________________,___________________。
(6)用化学方程式表示Na2S变浑浊的原因___________________________________。
(7)用离子方程式表示KMnO4溶液褪色的原因(MnO4-在酸性条件下被还原成Mn2+)__________________________________________。
(8)Na2O2与H2O反应的机理是(用化学方程式表示)第一步_____________________,第二步_______________________________。
(9)若向Na2O2中滴加适量的稀盐酸,也能产生同样的气体,请写出该反应的化学方程式___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成气的主要成分是 一氧化碳和氢气,是重要的化工原料。
I.已知下列反应:
①CH4(g) + H2O(g)![]() CO(g) + 3H2(g) ΔH = +206 kJ/mol
CO(g) + 3H2(g) ΔH = +206 kJ/mol
②C(s) + H2O(g) = CO(g) + H2(g) ΔH = +131 kJ/mol
(1)工业制取炭黑的方法之一是将甲烷隔绝空气加热到1300℃进行裂解。填写空白。
CH4(g)= C(s)+ 2H2(g) ΔH =______________kJ/mol。
(2)若800℃时,反应①的平衡常数K1=1.0,某时刻测得该温度下,密闭容器中各物质的物质的量浓度分别为:c(CH4)=4.0 mol·L-1;c(H2O)=5.0 mol·L-1;c(CO)=1.5 mol·L-1;c(H2)=2 mol·L-1,则此时该可逆反应的状态是_____________________(填“达到平衡”、“向正反应方向移动”或“向逆反应方向移动”)。
Ⅱ.甲醇是一种可再生能源,工业上用合成气来合成甲醇:CO(g)+2H2(g)![]() CH3OH(g),分析该反应并回答下列问题:
CH3OH(g),分析该反应并回答下列问题:
(3)一定条件下,将CO与H2以物质的量之比1:1置于恒容密闭容器中发生以上反应,能说明该反应已达到平衡的是_____________________________。
A.体系的压强不发生变化 B.混合气的密度保持不变
C.体系中碳元素的质量分数不变 D.CO与H2的物质的量之比保持不变
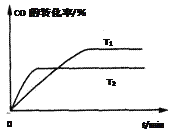
(4)如图是该反应在不同温度下CO的转化率随时间变化的曲线。T1和T2温度下的平衡常数大小关系是K1______K2 (填“>”、“<”或“=”)。理由是__________________________________________________。
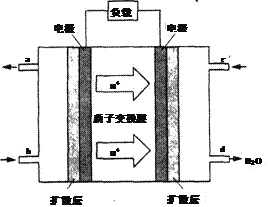
(5)已知甲醇燃料电池的工作原理如图所示。该电池工作时,电池左边的电极发生的电极反应式为______________________________。
(6)用甲醇燃料电池作为直流电源,设计如图装置制取Cu2O,电解总反应为:2Cu+H2O=Cu2O+H2↑。写出铜电极的电极反应式_______________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新旧动能转换工程之一是新能源新材料的挖掘和应用。乙二醇是重要的化工原料, 煤基合成气(CO、 H2)间接制乙二醇具有转化率高、回收率高等优点,是我国一项拥有自主知识产权的世界首创技术,制备过程如下:
反应 I: 4NO(g)+4CH3OH(g)+O2(g) ![]() 4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 = a kJ·mol-1
反应 II: 2CO(g)+2CH3ONO(g) ![]() CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
CH3OOCCOOCH3(l) + 2NO(g) △H2= b kJ·mol-1
反应 III: CH3OOCCOOCH3(1)+4H2(g) ![]() HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g) △H3= c kJ·mol-1
(1)请写出煤基合成气[n(CO): n(H2)= 1:2]与氧气间接合成乙二醇的总热化学方程式________,已知该反应在较低温条件下能自发进行,则该反应的△H ____0(填“>”“<”或“=”)。
(2)一定温度下,在 2 L 的密闭容器中投入物质的量均为 0.4mol的CO 和 CH3ONO发生反应 II,10min 达到平衡时CO的体积分数与NO的体积分数相等。
①下列选项能判断反应已达到化学平衡状态的是________。
a. CO 的质量不再变化 b. 混合气体的密度不再变化
c.单位时间内生成 CO 和 NO 的物质的量相等 d. CO 和 CH3ONO 的浓度比不再变化
②10min 内该反应的速率 ν(NO)=____________;该温度下化学平衡常数 K=_________。若此时向容器中再通入0.4 mol NO,一段时间后,达到新平衡时 NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
③若该反应△H<0,在恒容的密闭容器中,反应达平衡后,改变某一条件,下列示意图正确的是____________(填字母)。
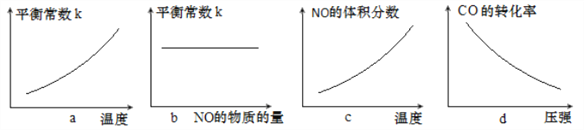
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com