
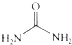
 的熔、沸点比醋酸
的熔、沸点比醋酸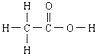 的高.
的高.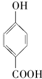 >
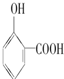
>
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
分析 ①结构相似的分子,含有氢键的物质熔沸点较高;
②醇、羧酸与水分子之间能形成氢键;
③冰中存在氢键,其体积变大;
④尿素分子间可以形成多个氢键(2个N原子、1个O原子),醋酸分子间只有1个氢键(只有羟基可以形成氢键);
⑤对羟基苯甲酸易形成分子之间氢键;
⑥稳定性与化学键有关.
解答 解:①氨气和膦的结构相似,但氨气分子中存在氢键,膦中只含分子间作用力,氢键的存在导致物质的熔、沸点升高,故①选;
②乙醇、乙酸与水分子之间能形成氢键,则可以和水以任意比互溶,故②正确;
③冰中存在氢键,其体积变大,则相同质量时冰的密度比液态水的密度小,故③正确;
④尿素分子间可以形成的氢键比醋酸分子间形成的氢键多,尿素的熔、沸点比醋酸的高,故④正确;
⑤对羟基苯甲酸易形成分子之间氢键,而邻羟基苯甲酸形成分子内氢键,所以邻羟基苯甲酸的熔、沸点比对羟基苯甲酸的低,故⑤正确;
⑥水分子高温下也很稳定,其稳定性与化学键有关,而与氢键无关,故⑥错误;
故选B.
点评 本题考查氢键及氢键对物质的性质的影响,明确氢键主要影响物质的物理性质是解答本题的关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 0.5mol/L | B. | 1mol/L | C. | 1.25mol/L | D. | 2.5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=0的溶液中:ClO-、Cu2+、SO42-、K+ | |
| B. | 使pH试纸变红色的溶液中:Fe2+、I-、NO3-、Cl- | |
| C. | 能够和金属镁反应放出气体的溶液中:Na+、H+、SO42-、Cl- | |
| D. | 常温下,水电离出的c(H+)与c(OH-)乘积为10-28的溶液中:K+、Na+、HS-、Ca2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
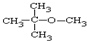 .
.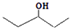 ,乙所含官能团的名称为羟基.
,乙所含官能团的名称为羟基.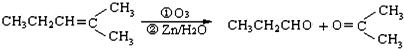
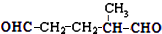 ,则烃A的结构可表示为
,则烃A的结构可表示为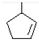 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | Ne | ||||
| 3 | Na | Mg | Al | Si | S | Cl |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
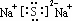 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com