
铬是人体必需的微量元素,但铬过量会引起污染,危害人体健康。不同价态的铬毒性不一样,六价铬的毒性最大。下列叙述错误的是( )
A.K2Cr2O7可以氧化乙醇,可用来鉴别司机是否酒后驾驶
B.污水中铬一般以Cr3+存在,与水中的溶解氧作用可被还原为六价铬
C.人体内六价铬超标,服用维生素C缓解毒性,说明维生素C具有还原性
D.1 mol 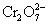 得到6 mol电子时,还原产物是Cr3+
得到6 mol电子时,还原产物是Cr3+
科目:高中化学 来源: 题型:
下列说法中错误的是
A.1mol CH2=CH2可以与Br2发生加成反应,消耗1 mol Br2
B.苯的邻位二元取代物只有一种,可以说明苯分子不具有碳碳单键和碳碳双键的交替结构
C.甲苯中所有原子都在同一平面内
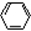
 D.苯乙烯( —CH=CH2)与立方烷( )互为同分异构体
D.苯乙烯( —CH=CH2)与立方烷( )互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K、L、M三个电子层。回答下列问题:
已知A、B、C、D、E、F、G都是周期表中前四周期的元素,它们的核电荷数依次增大,其中A、B、C、D、E为不同主族的元素。A、C的最外层电子数都是其电子层数的2倍,B的电负性大于C,透过蓝色钴玻璃观察E的焰色反应为紫色,F的基态原子中有4个未成对电子,G的+1价阳离子正好充满K、L、M三个电子层。回答下列问题:
(1)A、B、C、D、E、F、G几种元素中第一电离能最小的是___________ (填元素符号),D元素的原子核外有 种不同运动状态的电子;有 种不同能级的电子。基态的F3+核外电子排布式是 。
(2)B的气态氢化物在水中的溶解度远大于A、C的气态氢化物,原因是
。
(3)化合物AC2的电子式是 。
 (4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
(4)FD3与ECAB溶液混合,得到含多种配合物的血红色溶液,其中配位数为5的配合物的化学式是 。
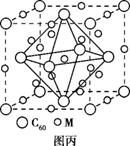
(5)化合物EF是一种蓝色晶体,右图
表示其晶胞的1/8(E+未画出)。该蓝色晶体
的一个晶胞中E+的个数为 。
(6)G的二价阳离子能与乙二胺(H2N—CH2一CH2一NH2)形成配离子:该配离子中含有的化学键类型有 。(填字母)
a.配位键 b.极性键 c.离子键 d.非极性键
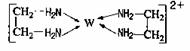
阴离子CAB-中的A原子与乙二胺(H2N—CH2一CH2一NH2)中C原子的杂化方式分别为 和 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列示意图与对应的反应情况正确的是
A B C D
A.含0.01molKOH 和0.01mol Ca(OH)2 的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2 溶液
C. n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
下列属于氧化还原反应的是( )
A.SO2+H2O====H2SO3
B.H2CO3====CO2↑+H2O
C.2NaOH+H2SO4====Na2SO4+2H2O
D.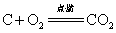
查看答案和解析>>
科目:高中化学 来源: 题型:
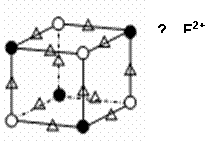
1)人体血红蛋白分子中含有Fe2+,正是这些Fe2+使血红蛋白分子具有载氧功能。亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+转化为Fe3+,生成高铁血红蛋白而丧失与氧气的结合能力,反应过程中Fe2+发生 反应,说明亚硝酸钠具有 性;误食亚硝酸钠中毒,可服维生素C缓解,说明维生素C具
有 性。
(2)稀土氟化物是金属热还原法制取单一稀土金属的重要原料。微波法合成CeF3的化学方程式为6CeO2+18NH4F====6CeF3+16NH3↑+12H2O+N2↑,该反应中氧化剂是 ,还原剂是 ,反应中被氧化的氮原子与未被氧化的氮原子物质的量之比为 。
(3)近年来,锂的含氢化合物作为氢源受到广泛关注。化合物LiNH2和LiH都是具有潜在应用价值的释氢材料。将LiNH2和LiH按一定比例混合,在催化剂作用下,所含氢全部以氢气形式放出同时生成Li3N,反应的化学方程式为 ,
反应中每生成0.1 mol H2,转移电子数为 NA。
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容器中反应A(g)+2B(g) C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。
C(g)分别在三种不同实验条件下进行,它们的起始浓度均为c(A)=0.100 mol·L-1,c(B)=0.200 mol·L-1,c(C)=0 mol·L-1。反应物A的浓度随时间的变化如图所示。
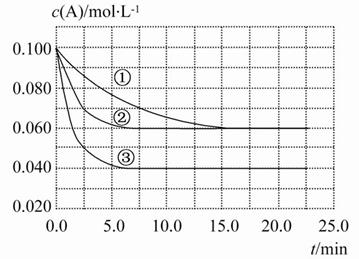
下列说法正确的是( )
A.若反应①、②的平衡常数分别为K1、K2,则K1<K2
B.反应A+2B C的ΔH>0
C的ΔH>0
C.实验②平衡时B的转化率为60%
D.减小反应③的压强,可以使平衡时c(A)=0.060 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
为了探究金属单质M与盐溶液的反应,某同学进行了下列实验,实验过程及现象如图所示,结合实验现象判断,该同学得出的下列结论中正确的是( )
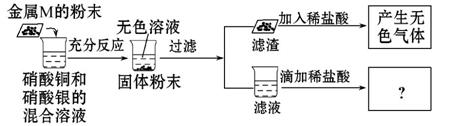
A.向滤液中滴加盐酸的实验现象是产生白色沉淀
B.滤渣可能是两种金属单质的混合物
C.滤渣在足量的稀硝酸中能完全溶解
D.加入的金属M可能是镁或钠
查看答案和解析>>
科目:高中化学 来源: 题型:
2012年国庆长假京城大堵车的场面“蔚为壮观”,大量汽车尾气(含CO、SO2和NO等)的排放带来了严重的城市空气污染,治理的方法之一是在汽车的排放管上装一个“催化转化器”,它能使一氧化碳跟一氧化氮反应生成可参与大气生态循环的无毒气体,并促进二氧化硫的转化。
(1)汽车尾气中导致酸雨形成的主要物质是 。
(2)写出在催化剂的作用下CO跟NO反应的化学方程式: 。
(3)使用“催化转化器”的缺点是在一定程度上提高了排放废气的酸度,有可能促进了酸雨的形成,其原因是
__________________________________________________________________。
(4)下列各项措施中,有利于缓解城市空气污染的有 (填序号)。
A.充分利用太阳能,减少能源消耗
B.使用电动车辆,减少汽油消耗
C.植树种草,绿化环境
D.取缔燃煤炉和木炭烧烤,改用天然气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com