
| A、NaClO+CH3COOH═CH3COONa+HClO | ||||
B、Cu2(OH)2CO3
| ||||
| C、2NO2+2NaOH═NaNO3+NaNO2+H2O | ||||
| D、3CCl4+K2Cr2O7═2CrO2Cl2+3COCl2+2KCl |
| ||


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验序号 | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
| 2 | 800 | C2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 800 | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
| 4 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCN难溶于水 |
| B、MnO2不能与HCN反应生成(CN)2 |
| C、HCN易形成白雾 |
| D、(CN)2和NaOH溶液反应生成NaCN、NaCNO和H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.0 mol |
| B、1.6 mol |
| C、1.2 mol |
| D、0.8 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
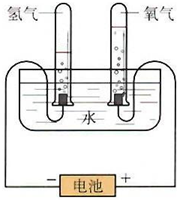 某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.
某学习小组根据图中所示的电解水原理进行实验,并对实验得到的与查阅资料获得的数据进行处理、分析,请与他们一起进行探究.请按要求填写.| 质量g | 物质的量mol | H2 和O2物质的量的比 | |
| H2 | |||
| O2 |
| 条件 | 物质 | 1mol物质的体积 |
| 0℃101kPa | H2 | 22.3L |
| O2 | 22.4L | |
| CO2 | 22.4L | |
| 25℃101kPa | H2 | 24.4L |
| O2 | 24.5L | |
| CO2 | 24.5L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、同温度、同体积的N2和CO |
| B、同密度、同体积的H2和N2、 |
| C、同温度、同压强的C2H4和C3H6 |
| D、同质量、不同密度的N2O和CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,含有NA个氦原子的氦气的体积约为11.2L |
| B、标准状况下,44.8L H2O的分子数为2NA |
| C、常温常压下,22g CO2含有原子总数为1.5NA |
| D、含有1mol HCl 的稀盐酸与足量的铁发生反应,转移的电子总数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、熔融状态下NaHSO4电离方程式:NaHSO4=Na++H++SO42- |
| B、碳酸氢铵溶液中加入足量氢氧化钠:HCO3-+OH-=CO32-+H2O |
| C、钠投入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| D、氯化亚铁溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com