
【题目】我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法。
I.已知:2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则反应:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) △H= kJ/mol。
2Fe(s)+3CO2(g) △H= kJ/mol。
II.反应1/3Fe2O3(s)+CO(g)![]() 2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
2/3Fe(s)+CO2(g)在1000℃的平衡常数等于4.0。在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡。
(1)CO的平衡转化率= _____________。
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是________
a.提高反应温度
b.增大反应体系的压强
c.选取合适的催化剂
d.及时吸收或移出部分CO2
e.粉碎矿石,使其与平衡混合气体充分接触
III.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+ 2H2(g)![]() CH3OH(g)。请根据图示回答下列问题:
CH3OH(g)。请根据图示回答下列问题:

(1)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=____________。
(2)若在一体积可变的密闭容器中充入l molCO、2molH2和1molCH3OH,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则该反应向____________(填“正”、“逆”)反应方向移动。
(3)以甲烷为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

1)B极上的电极反应式为 。
2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,当阳极收集到11.2L(标准状况)气体时,消耗甲烷的体积为 L(标准状况下)。
【答案】I.(1)-23.5 60%(2)d
II.(1)0.15mol/(L.min)(2)正(3)CH4-8e-+402-=CO2+2H2O 5.6
【解析】
试题分析:I.已知:①2CO(g)+O2(g)=2CO2(g)△H=-566kJ/mol
②2Fe(s)+3/2O2(g)=Fe2O3(s) △H=-825.5 kJ/mol
则根据盖斯定律可知①×3/2-②即可得到反应:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的反应热△H=-23.5kJ/mol。
2Fe(s)+3CO2(g)的反应热△H=-23.5kJ/mol。
II.(1)设CO的转化浓度为x,则
![]() Fe2O3(s)+ CO(g)
Fe2O3(s)+ CO(g) ![]()
![]() Fe(s)+ CO2(g)
Fe(s)+ CO2(g)
初始浓度(molL1) 0.1 0.1
转化浓度(molL1) x x
平衡浓度(molL1) 0.1—x 0.1+x
根据平衡常数可得:(0.1+x)/(0.1—x)=4,解得x=0.06molL1,则CO的平衡转化率60%。
(2)a.正反应是放热反应,升高温度平衡向逆反应方向进行,转化率降低,a错误;b.反应前后体积不变,增大反应体系的压强平衡不移动,转化率不变,b错误;c.催化剂不能改变平衡状态,则选取合适的催化剂不能改变转化率,c错误;d.及时吸收或移出部分CO2,平衡向正反应方向移动,转化率增大,d正确;e.粉碎矿石,使其与平衡混合气体充分接触可以加快反应速率,但不能影响平衡状态,转化率不变,e错误,答案选d。
III.(1)根据图像可知反应进行到10min时达到平衡状态,生成甲醇的浓度是0.75mol/L,则根据方程式可知消耗氢气的浓度是1.5mol/L,所以用氢气表示的反应速率为1.5mol/L÷10min=0.15mol/(Lmin)。
(2)反应前l molCO、2molH2和1molCH3OH的平均摩尔质量为(1mol×28g/mol+2mol×2g/mol+1mol×32g/mol)÷4mol=16g/mol,达到平衡吋测得混合气体的密度是同温同压下起始的1.6倍,则平衡时平均摩尔质量为29g/mol×1.6=46.4g/mol,说明反应向平均摩尔质量增大的方向即正反应方向移动。
(3)B电极通入甲烷转化为CO2,这说明甲烷被氧化发生氧化反应,则B电极是负极,电极反应式为CH4+4O2﹣﹣8e﹣=CO2+2H2O;
(4)惰性电极电解硫酸铜溶液阳极氢氧根放电,当阳极收集到11.2L(标准状况)气体,即0.5mol氧气时转移0.5mol×4=2mol电子。1分子甲烷失去8个电子,则根据得失守恒可知消耗甲烷是2mol÷8=0.25mol,在标准状况下的体积为0.25mol×22.4L/mol=5.6L。


 高效智能课时作业系列答案
高效智能课时作业系列答案科目:高中化学 来源: 题型:
【题目】某元素的同位素![]() ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,求:
(1)Z值和A值。
(2)X元素在周期表中的位置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铁是重要工业颜料,以废铁屑为原料制备氧化铁的步骤如下:(部分操作和条件略)
步骤1:用碳酸钠溶液洗去铁屑表面的油污。
步骤2:加入稍过量的稀硫酸,保持50~80℃,充分反应后,过滤。
步骤3:将滤液与稍过量的NH4HCO3溶液混合,得到FeCO3的浊液。
步骤4: 、 、干燥,得到FeCO3固体。
步骤5:煅烧FeCO3,得到Fe2O3固体。
(1)步骤2中,如何判断反应已经充分? 。
(2)步骤2所得的滤渣中主要含有一种铁的化合物W(Fe3C),经以下处理后,回收利用:W在足量的空气中高温煅烧,生成有磁性的固体X;将X溶于稀硫酸。
①煅烧时1 mol W消耗O2 mol。
②X溶于稀硫酸的离子方程式为 。
(3)步骤3生成FeCO3反应的化学方程式为 。
(4)将步骤4补充完整: 、 。
(5)若煅烧时条件控制不当,会使产品中存在杂质FeO。
①若要设计实验检验产品中是否存在FeO,且只能选用两种试剂,这两种试剂是 。
②现煅烧116.0 kg的FeCO3,得到79.2 kg产品,则该产品的纯度为__________。(设产品中只有一种杂质FeO,计算结果保留3位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质由于温度不同而能发生不同氧化还原反应的是( )
A. 大理石与盐酸 B. NaOH与AlCl3溶液 C. Zn与H2SO4溶液 D. Fe与浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对三联苯是一种有机合成的中间体。工业上合成对三联苯的化学方程式为
![]()
下列说法中不正确的是( )
A. 上述反应属于取代反应
B. 对三联苯的一氯取代物有3种
C. 1 mol对三联苯在足量的氧气中完全燃烧消耗21.5 mol O2
D. 对三联苯分子中至少有16个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中,我们经常看到铁制品生锈、铝制品表面出现白斑等众多的金属腐蚀现象。可以通过下列装置所示实验进行探究。下列说法正确的是
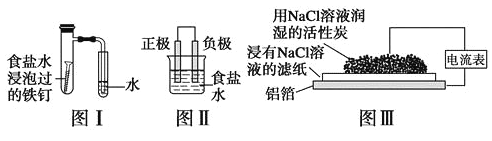
A.按图Ⅰ装置实验,为了更快更清晰地观察到液柱上升,可采用下列方法:用酒精灯加热具支试管
B.图Ⅱ是图Ⅰ所示装置的原理示意图,图Ⅱ的正极材料是铁
C.铝制品表面出现白斑可以通过图Ⅲ装置进行探究,Cl-由活性炭区向铝箔表面区迁移,并发生电极反应:2Cl--2e-=Cl2↑
D.图Ⅲ装置的总反应为4Al+3O2+6H2O=4Al(OH)3,生成的Al(OH)3进一步脱水形成白斑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇的下列反应与其官能团无直接关系的是( )
A.乙醇与活泼金属反应
B.乙醇和氧气在Cu的催化下反应
C.乙醇被酸性高锰酸钾氧化
D.乙醇在空气中点燃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以橄榄石(主要成分是Mg9FeSi5O20)等为原料生产硅胶、碱式碳酸镁[Mg2(OH)2CO3]的部分工艺流程如下图所示:

(1)Mg9FeSi5O20中铁元素的化合价为 ,为提高镁的浸出率,可采用的两种主要措施是 渣料II的成分是 。
(2)若试剂b是氯碱工业中的某种气体产物,写出加入b后反应的离子方程式 。试剂c的用途是调节溶液的pH,比较恰当的物质是 (写化学式,后同),余液中溶质的主要成分是 。
(3)操作I的名称是 ,写出生成碱式碳酸镁(同时有气体生成)的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com