
| A、0.1mol Fe 与0.1mol Cl2充分反应,转移的电子数为0.3 NA |
| B、常温常压下,1mol的氦气和氢气混合气,含有的核外电子数为2NA |
| C、25℃时,1L pH=13的Ba(OH)2溶液中含有OH-的数目为0.2 NA |
| D、标准状况下,2.24L CCl4和CH2O的混合物中含有NA个碳原子 |
| 10-14 |
| 10-13 |


科目:高中化学 来源: 题型:
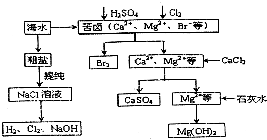
查看答案和解析>>
科目:高中化学 来源: 题型:
| X | Y | ||
| Z | W | Q |
| A、W得电子能力比Q强 |
| B、由Z与Y组成的物质在熔融时能导电 |
| C、钠与Y可能形成Na2Y2化合物 |
| D、X有多种同素异形体,而Y不存在同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,若阴极得到电子数为2NA,阳极减少64g |
| B、200mL某硫酸强碱盐中含有1.5NA个SO42-离子,同时含有NA个金属阳离子,该盐物质的量浓度是2.5mol/L |
| C、常温常压下78g Na2O2固体中所含阴、阳离子总数为4NA |
| D、一定条件下足量的Fe粉与浓硫酸反应,转移电子数一定为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将2molSO3气体通入一密闭容器中,达平衡后吸收QkJ热量,则2SO3(g)?2SO2(g)+O2(g)△H=+Q KJ/mol |
| B、向含有0.4molFeBr2的溶液中通入0.2molCl2充分反应:2Fe2++Cl2=2Fe3++2Cl- |
| C、NH4Al(SO4)2溶液中加入Ba(OH)2溶液使SO42-完全沉淀:Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O |
| D、将FeCl3饱和溶液滴入沸水中制取Fe(OH)3胶体:Fe3++3H2O?Fe(OH)3↓+3H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、元素周期表有7个主族,8个副族 |
| B、元素周期表有3个长周期、4个短周期 |
| C、第ⅢA族位于元素周期表的第三列(从左往右) |
| D、0族位于元素周期表的第18列(从左往右) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、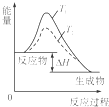 温度T1>T2,SO2与O2反应过程中的能量变化 |
B、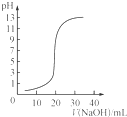 表示0.1000mol/L NaOH溶液滴定20.00mL0.1000mol/LCH3COOH溶液所得到的滴定曲线 |
C、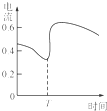 表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2 |
D、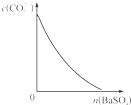 表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32-)的浓度变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ①H2SO4溶液: HSO4- H++SO42- | ②NaHSO4溶液: HSO4- H++SO42- | ③盐酸 HCl=H++Cl |
| 10% | 29% | 100% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com