


科目:高中化学 来源: 题型:
| A、NaHSO4 溶液与Ba(OH)2溶液反应至中性:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O |
| B、向FeCl2溶液中通入氯气:Fe2++Cl2=Fe3++2Cl- |
| C、向Ca(ClO)2溶液中通入过量的SO2:ClO-+SO2+H2O=HClO+HSO3- |
| D、FeSO4酸性溶液中加H2O2:2Fe2++H2O2=2Fe3++2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(OH-) |
| c(OH-) |
| c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某温度下,相同pH值的盐酸和醋酸溶液,pH值随溶液体积变化的曲线如图,据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液,pH值随溶液体积变化的曲线如图,据图判断正确的是( )| A、Ⅱ为盐酸稀释时pH值变化曲线 |
| B、a点Kw的数值比c点Kw的数值大 |
| C、b点溶液的导电性比c点溶液的导电性强 |
| D、b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:
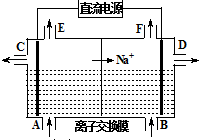 电解原理在工业生产中有广泛的应用.
电解原理在工业生产中有广泛的应用.
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 将0.1mol A12O3、0.1mol SiO2和一定量的Fe2O3、NaOH的固体混合物溶于水,充分反应后,向所得反应体系中缓缓通人0.5mol HC1气体,所得难溶物的物质的量与HC1的物质的量的关系如图所示.下列说法正确的是( )
将0.1mol A12O3、0.1mol SiO2和一定量的Fe2O3、NaOH的固体混合物溶于水,充分反应后,向所得反应体系中缓缓通人0.5mol HC1气体,所得难溶物的物质的量与HC1的物质的量的关系如图所示.下列说法正确的是( )| A、Fe2O3、NaOH的物质的量分别是0.1mol、0.5mol |
| B、结合H+的能力:SiO32->AlO2- |
| C、A点溶液呈碱性,B、C两点溶液呈中性 |
| D、当n(HCl)>0.5mol时,难溶物的量会继续增多 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间 | 0min | 2min | 4min | 6min | 8min | 10min |
| Z的浓度mol/L | 0 | 0.8 | 1.2 | 1.4 | 1.4 | 1.4 |
| A、用Y来表示0-4min的平均反应速率为0.15mol/(L?min) |
| B、该温度下反应的化学平衡常数为18.15 |
| C、向平衡体系中再加入2molX和1mol Y,达到新的平衡时X的体积分数增大 |
| D、对平衡体系降低温度,化学反应后速率减慢,但Y的转化率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.
如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、X只能是第三周期元素 |
| B、a-b+n+m=10或16 |
| C、b不大于6 |
| D、Y不可能是第二周期元素 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com