
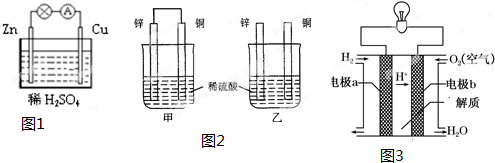
分析 (1)活泼性强的金属作负极发生氧化反应,活泼性弱的作正极,正极上溶液中的阳离子得电子发生还原反应;电子从负极流向正极;根据锌片的质量减少了6.5g结合转移电子相等计算生成氢气的体积;
(2)甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,总反应式为:Zn+H2SO4=ZnSO4+H2↑;乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,以此进行分析;
(3)燃料电池中,通入氧气的电极为正极;氢氧燃料电池反应式就是氢气燃烧方程式.
解答 解:(1)Zn-Cu-H2SO4组成的原电池中,活泼性强的金属Zn作负极发生氧化反应,电极反应为:Zn-2e-=Zn2+;活泼性弱的Cu作正极,正极上溶液中的阳离子得电子发生还原反应,电极反应为:2H++2e-=H2↑;电子从负极流向正极;根据转移电子相等得生成氢气的体积=$\frac{6.5g}{65g/mol}$×22.4L/mol=2.24L,
故答案为:Zn;氧化;2H++2e-=H2↑;负;正;2.24;
(2)①甲中形成铜锌原电池,锌作负极,失电子,铜作正极,H+在铜极上得电子,生成H2,所以甲中铜片表面有气泡产生,乙装置中只是锌片与稀硫酸间发生了置换反应:Zn+H2SO4=ZnSO4+H2↑,铜表面无现象,故答案为:甲中铜片表面有气泡产生,乙中铜片表面无现象;
②甲中铜片上氢离子得电子生成氢气,乙中锌和稀硫酸发生置换反应生成氢气,所以两烧杯的溶液中氢离子浓度均减小,所以两烧杯中溶液的pH均增大,故答案为:增大;
③甲中形成铜锌原电池加快了反应速率,所以产生气泡的速度甲比乙快,故答案为:大于;
(3)燃料电池中,通入氧气的电极为正极,所以b是正极;氢氧燃料电池反应式就是氢气燃烧方程式,则电池反应式为2H2+O2═2H2O,故答案为:b;2H2+O2═2H2O.
点评 本题考查原电池的工作原理,侧重于基础知识的考查,题目难度不大,注意两极电极反应转移的电子数目相等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 用KSCN溶液检验Fe2+ | B. | 用湿润的红色石蕊试纸检验氨气 | ||
| C. | 用湿润的淀粉碘化钾试纸检验氯气 | D. | 用硝酸酸化的AgNO3溶液检验Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | A>C>D>B | C. | C>A>B>D | D. | B>D>C>A |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 请认真观察如图,然后回答问题.
请认真观察如图,然后回答问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3(固) | B. | NaCl溶液 | C. | KNO3溶液 | D. | CuSO4(固) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |
| B. |
| C. |
| D. |
|
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
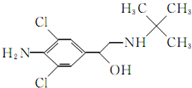 食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )
食品安全是现今百姓生活中热议问题之一,瘦肉精学名盐酸克伦特罗,白色或类白色的结晶粉末,无臭、味苦,熔点161℃,溶于水、乙醇,微溶于丙酮,不溶于乙醚.其结构简式如图.有关瘦肉精的说法不正确的是( )| A. | 化学式为C12H18ONCl2 | |
| B. | 遇FeCl3溶液发生显色反应 | |
| C. | 属于芳香族化合物 | |
| D. | 可以发生取代、加成、水解、酯化、消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
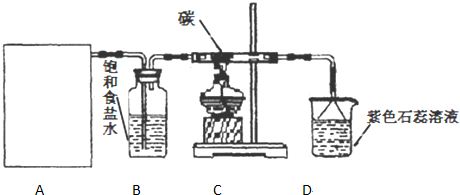
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数为34 | B. | 还原性:H2Se<H2S | ||
| C. | 酸性:H2SeO4<HBrO4 | D. | 稳定性:H2Se>AsH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com