
| A. | 0.168L | B. | 0.112L | C. | 0.672L | D. | 0.224L |
分析 10mL混合酸中含有:n(H+)=0.01L×2×1mol/L+0.01L×0.5mol/L=0.025mol,n(NO3-)=0.01L×0.5mol/L=0.005mol,由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,以此计算该题.
解答 解:10mL混合酸中含有:n(H+)=0.01L×2×1mol/L+0.01L×0.5mol/L=0.025mol,n(NO3-)=0.01L×0.5mol/L=0.005mol,
由于铁过量,则发生反应:3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O,Fe+2H+=Fe2++H2↑,则
3Fe+2NO3-+8H+=3Fe2++2NO↑+4H2O
0.005mol 0.02mol 0.005mol
反应后剩余n(H+)=0.025mol-0.02mol=0.005mol,
Fe+2H+=Fe2++H2↑
0.005mol 0.0025mol
所以:n(NO)+n(H2)=0.005mol+0.0025mol=0.0075mol,
V(NO)+V(H2)=0.0075mol×22.4L/mol=0.168L,
故选A.
点评 本题考查混合物的计算,题目难度中等,本题注意铁过量,根据n(H+)、n(NO3-)判断反应的可能性,判断生成气体为NO和H2的混合物,进而计算气体的体积,题目易错.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 原混合溶液中c(K+)为2mol•L-1 | B. | 上述电解过程中共转移2mol电子 | ||
| C. | 电解得到铜的物质的量为0.5mol | D. | 电解后溶液中c(H+)为2mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NO2-和${NH}_{2}^{-}$ | B. | H3O+和ClO3- | C. | NO3-和CH3+ | D. | PO43-和SO42-. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上用电解熔融氧化物的方法制备C单质 | |
| B. | 离子半径:C>D | |
| C. | 熔融它们的单质,所克服的微粒间作用力都相同 | |
| D. | 含D的盐溶液都显酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
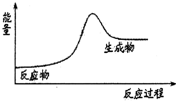
| A. | H2在Cl2中燃烧 | B. | Ba(OH)2•8H2O和NH4Cl固体的反应 | ||
| C. | Na和H2O的反应 | D. | 生石灰溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现象 | 结论 |
| A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间. | 实验2先褪色 | H2C2O4浓度越大反应速率越快. |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向砖红色Ag2CrO4沉淀上滴加 0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com