
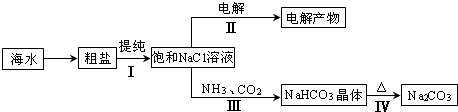
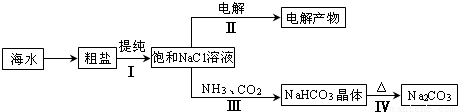
利用海水资源进行化工生产的部分工艺流程如图:

(1)流程I中,欲除去粗盐中含有的Ca2+、Mg2+、SO42-等离子,需将粗盐溶解后,按序加入药品进行沉淀、过滤等。加入药品和操作的顺序可以是 。
a.Na2CO3、NaOH、BaCl2、过滤、盐酸 b.NaOH、BaCl2、Na2CO3、过滤、盐酸
c.NaOH、Na2CO3、BaCl2、过滤、盐酸 d.BaCl2、Na2CO3、NaOH、过滤、盐酸
(2)流程II中,电解饱和NaCl溶液的离子方程式为 。通电开始后,阳极区产生的气体是 ,阴极附近溶液pH会 (填“增大”、“减小”或“不变”)。
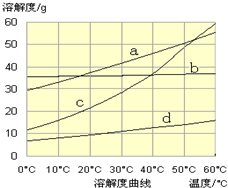
(3)流程III中,通过反应得到NaHCO3晶体。下图为NaCl、NH4Cl、NaHCO3、NH4HCO3的溶解度曲线,其中能表示NaHCO3溶解度曲线的是 ,化学反应方程式是 。

(4)流程IV中,所得纯碱常含有少量可溶性杂质,提纯它的过程如下:将碳酸钠样品加适量水溶解、 、 、过滤、洗涤2-3次,得到纯净Na2CO3•10H2O,Na2CO3•10H2O脱水得到无水碳酸钠,已知:
Na2CO3·H2O(s)==Na2CO3(s)+H2O(g) ΔH1=+58.73kJ·mol-1
Na2CO3·10H2O(s)==Na2CO3·H2O(s)+9H2O(g) ΔH2= +473.63 kJ·mol-1
把该过程产生的气态水完全液化释放的热能全部用于生产Na2CO3所需的能耗(不考虑能量损失),若生产1molNa2CO3需要耗能92.36kJ,由此得出:H2O(g)==H2O(l) △H = 。
(16分)
(1)bd(3分,只选b或d得1分,全对得3分,凡其它有错答案不得分)。
(2) 2Cl-+2H2O 2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)
2OH-+H2↑+Cl2↑(2分,写“通电”不扣分、漏反应条件、无“↑”、未配平只扣1分); Cl2(或氯气)(1分),增大(1分)
(3)d (2分) NaCl + CO2 + NH3 + H2O== NaHCO3↓+ NH4Cl(2分,未写“↓”扣1分)
(4)蒸发浓缩 冷却结晶(2分) — 44.00 kJ/mol(3分,无单位扣1分,没有符号“-”的不得分)
【解析】
试题分析:(1)a项,虽然能除去杂质及过量碳酸钠和氢氧化钠,但是过量氯化钡没有除去,故a选项错误;b项,既能除去杂质及过量的氢氧化钠、氯化钡、碳酸钠,又不引入新的杂质,故b选项正确;c项,虽然能除去杂质及过量的氢氧化钠、碳酸钠,但是过量的氯化钡没有除去,故c选项错误;d项,既能除去杂质及过量的氯化钡、碳酸钠、氢氧化钠,又不引入新的杂质,故d选项正确;(2)用惰性电解饱和食盐水可以制备氢氧化钠、氢气、氯气,该反应实质为2Cl-+2H2O 2OH-+H2↑+Cl2↑;阴离子移向阳极,氯离子比氢氧根离子容易失去电子,发生氧化反应,产生黄绿色的气体,即氯气;阳离子移向阴极,氢离子比钠离子容易得到电子,发生还原反应,则阴极产生无色气体,即氢气,由于氢离子被消耗,则阴极附近氢离子浓度减小,所以阴极附近溶液的pH增大;(3)流程III的反应属于复分解反应,即NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl(或者NH3+H2O==NH3•H2O、NH3•H2O+CO2==NH4HCO3、NH4HCO3+NaCl== NaHCO3↓+NH4Cl),该反应能够发生的原因是NH4HCO3、NaCl的溶解度均大于NaHCO3,则图中溶解度最小的d表示NaHCO3;(4)由于被提纯物和杂质都是可溶物,杂质可能是NaCl等,根据混合物分离提纯的方法推断,应选择结晶法分离出碳酸钠晶体,因此需要将碳酸钠样品加适量水溶解、蒸发浓缩、冷却结晶或降温结晶、过滤、洗涤,得到纯净的Na2CO3•10H2O,Na2CO3•10H2O脱水得到无水碳酸钠;先将已知两个热化学方程式编号为①②,观察发现①+②可得③Na2CO3·10H2O(s)==Na2CO3
(s)+10H2O(g) ΔH3= +532.36 kJ·mol-1,依题意可知④Na2CO3·10H2O(s)==Na2CO3
(s)+10H2O(l) ΔH4= +92.36 kJ·mol-1,观察发现(④—③)/10可以得到:H2O(g)== H2O(l)
ΔH=(ΔH4—ΔH3)/10= —44 kJ·mol-1。
2OH-+H2↑+Cl2↑;阴离子移向阳极,氯离子比氢氧根离子容易失去电子,发生氧化反应,产生黄绿色的气体,即氯气;阳离子移向阴极,氢离子比钠离子容易得到电子,发生还原反应,则阴极产生无色气体,即氢气,由于氢离子被消耗,则阴极附近氢离子浓度减小,所以阴极附近溶液的pH增大;(3)流程III的反应属于复分解反应,即NaCl+NH3+CO2+H2O==NaHCO3↓+NH4Cl(或者NH3+H2O==NH3•H2O、NH3•H2O+CO2==NH4HCO3、NH4HCO3+NaCl== NaHCO3↓+NH4Cl),该反应能够发生的原因是NH4HCO3、NaCl的溶解度均大于NaHCO3,则图中溶解度最小的d表示NaHCO3;(4)由于被提纯物和杂质都是可溶物,杂质可能是NaCl等,根据混合物分离提纯的方法推断,应选择结晶法分离出碳酸钠晶体,因此需要将碳酸钠样品加适量水溶解、蒸发浓缩、冷却结晶或降温结晶、过滤、洗涤,得到纯净的Na2CO3•10H2O,Na2CO3•10H2O脱水得到无水碳酸钠;先将已知两个热化学方程式编号为①②,观察发现①+②可得③Na2CO3·10H2O(s)==Na2CO3
(s)+10H2O(g) ΔH3= +532.36 kJ·mol-1,依题意可知④Na2CO3·10H2O(s)==Na2CO3
(s)+10H2O(l) ΔH4= +92.36 kJ·mol-1,观察发现(④—③)/10可以得到:H2O(g)== H2O(l)
ΔH=(ΔH4—ΔH3)/10= —44 kJ·mol-1。
考点:考查物质制备化学工艺流程,涉及粗盐的分离和提纯、电解饱和食盐水的原理、电极产物及电极附近溶液pH的变化、溶解度曲线在水溶液里复分解反应中的应用、化学方程式、盖斯定律、热化学方程式的书写等。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
查看答案和解析>>
科目:高中化学 来源:2010-2011学年辽宁省高三下学期模拟考试(理综)化学部分 题型:实验题海水资源
(15分)
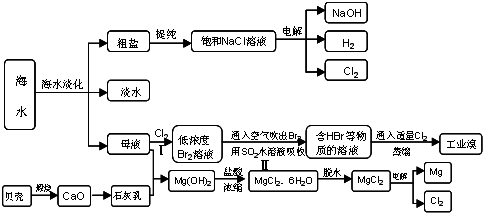
沿海地区有着丰富的海水资源,海水占地球总储水量的97.4﹪,海水是人类宝贵的自然资源,若把海水淡化和化工生产结合起来,既可以解决淡水资源缺乏的问题,又可以充分利用海水资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:

⑴请列举海水淡化的两种方法 、 。
⑵使用离子交换树脂与水中的离子进行交换也是常用的水处理技术。聚丙烯酸钠是一种离子交换树脂,写出聚丙烯酸钠单体的结构简式 .
⑶步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是: .
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
⑷在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
.
⑸电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以用做镁蒸气的冷却剂的是
A.H2 B.CO2 C.空气 D.O2 E.水蒸气
⑹苦卤(海水蒸发结晶分离出食盐后的母液)中含有较多的NaCl、MgCl2、KCl、MgSO4等物质.用沉淀法测定苦卤中MgCl2的含量(g/L),测定过程中应获取的数据有
.
查看答案和解析>>
科目:高中化学 来源:2012年北京市房山区高考化学二模试卷(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com