
【题目】下图甲是一种利用微生物将废水中的尿素[CO(NH2)2]的化学能直接转化为电能,并生成对环境友好物质的装置,同时利用此装置的电能在铁上镀铜,下列说法中正确的是
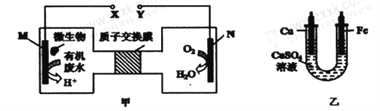
A. 铁电极应与Y相连接
B. H+透过质子交换膜由右向左移动
C. 当N电极消耗0.25mol气体时,则铁电极增重16g
D. M电极反应式:H2NCONH2+H2O-6e-=CO2↑+N2+6H+
 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案科目:高中化学 来源: 题型:
【题目】根据下列四种元素的第一至第四电离能数据(单位:kJ/mol),回答下面各题:
元素代号 | I1 | I2 | I3 | I4 |
R | 500 | 4600 | 6900 | 9500 |
S | 740 | 1500 | 7700 | 10500 |
T | 580 | 1800 | 2700 | 11600 |
U | 420 | 3100 | 4400 | 5900 |
(1)在周期表中,最可能处于同一族的是___________
A.S和U B.S和T C.T和U D.R和T E.R和U
(2)T的氯化物的化学式为___________________
(3)如果U元素是短周期的元素,你估计它的第2次电离能飞跃数据将是第_____个。
(4)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是_________,其中元素_______的第一电离能反常高的原因是_____________。
【答案】 E TCl3 10 R<S<T S S元素的最外层电子处于s能级全满,能量较低,比较稳定,失去一个电子吸收的能量较多
【解析】试题分析:本题考查电离能的分析和电离能的应用。R的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,R的第二电离能远大于第一电离能,R原子的最外层有1个电子;S的各级电离能:I1
I4,R的第二电离能远大于第一电离能,R原子的最外层有1个电子;S的各级电离能:I1![]() I2
I2![]() I4,S的第三电离能远大于第二电离能,S原子的最外层有2个电子;T的各级电离能:I1
I4,S的第三电离能远大于第二电离能,S原子的最外层有2个电子;T的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,T的第四电离能远大于第三电离能,T原子的最外层有3个电子;U的各级电离能:I1
I4,T的第四电离能远大于第三电离能,T原子的最外层有3个电子;U的各级电离能:I1![]() I2
I2![]() I3
I3![]() I4,U的第二电离能远大于第一电离能,U原子的最外层有1个电子。
I4,U的第二电离能远大于第一电离能,U原子的最外层有1个电子。
(1)根据上述分析,R原子和U原子的最外层有1个电子,最可能都处于IA族,最可能处于同一族的是R和U,答案选E。
(2)T原子的最外层有3个电子,T的化合价为+3价,T的氯化物的化学式为TCl3。
(3)根据上述分析,U的第1次电离能飞跃是失去第2个电子,U是短周期元素,估计U的第2次电离能飞跃是失去第10个电子时发生。
(4)若R、S、T是同周期的三种主族元素,R的最外层电子数为1,R位于第IA族,S的最外层电子数为2,S位于第IIA族,T的最外层电子数为3,T位于IIIA族,它们的原子序数由小到大的顺序为R![]() S
S![]() T。其中元素S的第一电离能反常的高,原因是:S的价电子排布式为ns2,S元素的最外层的s能级为全充满,能量较低,比较稳定,失去一个电子吸收的能量较多。
T。其中元素S的第一电离能反常的高,原因是:S的价电子排布式为ns2,S元素的最外层的s能级为全充满,能量较低,比较稳定,失去一个电子吸收的能量较多。
点睛:解答本题的关键是理解各级电离能与元素原子的最外层电子数之间的关系,如果某元素的In+1In,该元素原子的最外层电子数为n。知道同一周期中第IIA族、第VA族元素的第一电离能大于相邻元素的原因。
【题型】填空题
【结束】
20
【题目】有原子序数依次增大的A、B、C、D、E、F、G七种元素,A元素的原子是周期表中半径最小的原子,B原子最外层电子数是次外层电子数的1.5倍,元素C在自然界中形成物质种类最多,E、F、G三种元素原子的质子数之和为62,E元素原子2p轨道上有两个未成对电子,G元素原子4p轨道上有1个未成对电子,且它的阴离子具有跟氪相同的电子层结构,E、F、G能够形成多种常见的盐。请回答下列问题:
(1)E元素原子的价层电子的电子排布图为________;F元素原子基态时的电子排布式:______,E、F形成的化合物之一能够与水反应放出气体,写出该化合物与水反应的离子方程式:______。
(2)B、D、F均可与G形成化合物
①用电子式表示F、G形成的化合物的过程:__________。
②BG3和DG3中心原子的杂化方式分别为__________和____________。电负性大小关系为B____D;第一电离能介于B和D之间的第二周期元素有________种。
(3)C、E能形成两种常见的化合物,根据等电子原理,写出CE分子的结构式____。
(4)由A、C、E形成的气态化合物X,其分子的空间构型是___;1 molX分子中σ键的数目为____;X可被催化氧化,该反应的催化剂含有Cu、Zn、Ag、Fe等元素。基态Fe原子的电子排布了____________个能级,有_________个运动状态,在周期表中在_______区。向黄色FeCl3溶液中加入无色KSCN溶液,溶液变成红色。该反应在有的教材中用方程式FeCl3+3KSCN==Fe(SCN)3+3KCl表示。生成物中KCl既不是难溶物、难电离的物质,也不是易挥发物质,该反应之所以能进行的原因是___________。经研究表明Fe(SCN)3是配合物,Fe3+与SCN-不仅能以1:3的个数比配合,还可以其他个数比配合。
①所得Fe3+和SCN-的配合物中,主要是Fe3+与SCN-以个数比1:1配合所得离子显红色。该配合物离子的化学式是__________________。
②若Fe3+与SCN-以个数比1:5配合,则FeCl3与KSCN在水溶液中发生反应的化学方程式可以表示为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某+2价离子的电子排布式为1s22s22p63s23p63d9 ,该元素在周期表中所属的族是
A. ⅠB B. ⅡB C. Ⅷ D. ⅡA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)将碳酸钙、稀盐酸、铁、氧气四种物质填写到下面的适当位置。

___________、___________、___________、___________。
(2)从(1)中的四种物质中选出一种或几种为反应物,按下述反应类型,各写一个化学方程式。
①分解反应:_______________________________;
②化合反应:_______________________________;
③置换反应:_______________________________;
④复分解反应:_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列仪器:

(1)海水蒸馏是由海水获得淡水的常用方法之一,在实验室里组成一套蒸馏装置肯定 需要上述仪器中的一部分,按照实验仪器从下到上、从左到右的顺序,依次是__________ (填序号);仪器⑤的冷凝水应从________(填“a”或“b”)口进入。
(2)海带等藻类物质经过处理后,可以得到碘水,欲从碘水中提取碘,需要上述仪器 中的______(填序号),该仪器名称为__________,向该碘水中加入四氯化碳以提取碘 单质的实验操作叫做_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:
Cu(s)+Cu2+(aq)![]() 2Cu+(aq) ΔH1=a kJ·mol-1
2Cu+(aq) ΔH1=a kJ·mol-1
Cl—(aq)+Cu+(aq)![]() CuCl(s) ΔH2=b kJ·mol-1
CuCl(s) ΔH2=b kJ·mol-1
实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。下列说法正确的是

A. 溶液pH越大,Ksp(CuCl)增大
B. 向电解液中加入稀硫酸,有利于Cl-的去除
C. 反应达到平衡增大c(Cu2+),c(Cl—)减小
D. ![]() Cu(s)+
Cu(s)+![]() Cu2+(aq)+Cl—(aq)
Cu2+(aq)+Cl—(aq)![]() CuCl(s)的ΔH=(a+2b) kJ·mol-1
CuCl(s)的ΔH=(a+2b) kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】摩尔盐[(NH4)2Fe(SO4)2·6H2O]是一种重要的化工原料,可用于制取纳米Fe3O4和草酸合铁酸钾等。
(1)取一定质量摩尔盐样品与过量NaOH溶液反应。
①根据生成气体的体积计算得到摩尔盐的纯度小于实际值,其原因是______。
②向所得Fe(OH)2沉淀中加入NaNO2溶液可制得纳米Fe3O4,同时产生NO。该反应的离子方程式为______。
(2)摩尔盐经氧化后与KOH和H2C2O4反应可得到草酸合铁酸钾[KaFeb(C2O4)c·dH2O],其中Fe元素化合价为+3。
①已知25 ℃,H2C2O4的电离常数Ka1=5.6×10-2,Ka2=5.4×10-5。pH=4的H2C2O4溶液中c(C2O![]() ):c(HC2O)=______。
):c(HC2O)=______。
②为了确定草酸合铁酸钾的组成,准确称取4.910 g样品在氮气气氛下加热,固体样品的剩余质量随温度的变化如图所示。
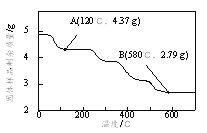
已知:a.120℃时已完全失去结晶水。
b.200℃~580℃分解产生的CO和CO2恢复至标准状况下体积为1.008 L。
c.580℃以上残留固体为FeO和K2CO3的混合物。
根据以上实验数据计算草酸合铁酸钾中的n(Fe3+):n(C2O42-)_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸钠、碳酸氢钠与盐酸反应的比较。

(1)按上图要求完成实验:在两支试管中分别加入3 mL稀盐酸,将两个各装有少量等质量的碳酸钠、碳酸氢钠粉末的小气球套在两支试管的管口。将气球内的碳酸钠和碳酸氢钠同时倒入试管中,观察到的实验现象是_________。
(2)实验结论是_____________________。
(3)碳酸钠与盐酸反应的化学方程式是____________,离子方程式是_________________。
(4)碳酸氢钠与盐酸反应的化学方程式是____________,离子方程式是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com