NA表示阿伏加德罗常数,下列说法正确的是( )
A.1molNa与足量O2反应生成Na2O或Na2O2均失去NA个电子
B.1molAl分别放入足量的冷的浓HNO3、稀HNO3中,反应后转移的电子均为3NA个
C.各5.6g铁分别与足量的盐酸、氯气反应,电子转移总数均为0.3NA
D.2.7g铝与足量的NaOH溶液反应,转移的电子总数为NA
【答案】
分析:A、1molNa与足量O
2反应生成Na
2O或Na
2O
2,钠元素在化合物中的化合价都是+1价,失电子数都是N
A个;
B、1molAl分别放入足量的冷的浓HNO
3、稀HNO
3中,发生的反应不同,Al放入足量的冷的浓HNO
3中表面会形成氧化膜而阻止反应进一步发生;
C、铁与足量的盐酸、氯气的反应不同,分别生成FeCl
2和FeCl
3,转移电子数不一样;
D、2.7g铝与足量的NaOH溶液反应为2Al+2NaOH+2H
2O═2NaAlO
2+3H
2↑,可根据方程式判断失去的电子数.
解答:解:A、Na元素在两种化合物中都是+价,所以1molNa与足量O
2反应生成Na
2O或Na
2O
2均失去N
A个电子,故A正确;
B、Al放入足量的冷的浓HNO
3中表面会形成氧化膜而阻止反应进一步发生,所以转移电子数小于3N
A,故B错误;
C、Fe+2HCl═FeCl
2+H
2↑,2Fe+3Cl
2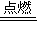
2FeCl
3,所以5.6gFe与盐酸反应转移0.2N
A个电子,而与Cl
2反应则转移0.3N
A个电子,故C错误;
D、发生反应2Al+2NaOH+2H
2O═2NaAlO
2+3H
2↑,2.7gAl转移电子0.3N
A个,故D错误.
故选A.
点评:本题考查阿佛加德罗常数问题,主要涉及元素化合物知识,注意把握金属在不同条件下的性质.本题难度不大.

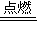 2FeCl3,所以5.6gFe与盐酸反应转移0.2NA个电子,而与Cl2反应则转移0.3NA个电子,故C错误;
2FeCl3,所以5.6gFe与盐酸反应转移0.2NA个电子,而与Cl2反应则转移0.3NA个电子,故C错误;
