
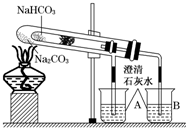
 ����ʵ�顱�ǽ�һ֧��С���Թ�װ����һ�Թ��У�����װ�����ԭ����Ҫ��ֻ������Թܽ��е�ʵ�飮�����������ŵ㣬���������㷺������Ӧ���ڻ�ѧʵ���У��������ʵ��Ϊ����ʵ�顱��ʵ��װ���У�С�Թ��в���մ����ˮ����ͭ��ĩ����֬�ޣ���۲�ʵ��װ�ã�����ʵ��ԭ�������ش��������⣺
����ʵ�顱�ǽ�һ֧��С���Թ�װ����һ�Թ��У�����װ�����ԭ����Ҫ��ֻ������Թܽ��е�ʵ�飮�����������ŵ㣬���������㷺������Ӧ���ڻ�ѧʵ���У��������ʵ��Ϊ����ʵ�顱��ʵ��װ���У�С�Թ��в���մ����ˮ����ͭ��ĩ����֬�ޣ���۲�ʵ��װ�ã�����ʵ��ԭ�������ش��������⣺
| ||
| ||



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�����һԪǿ�� |
| B��NaHSO4����ʽ�� |
| C��Na2O2������������ |
| D��Һ�ȣ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �������ȼҵ����Ҫ��Ʒ֮һ����һ�ֳ��õ���������������ԭ������ˮ��Ӧ�����˴����Cl2+H2O?HCl+HClO��K=4.5��10-4���������ǿ��������ɱ��ˮ�еIJ�������ֱ���ô�����Ϊ����ˮ��������Ϊ�������ֽ⣬�Ҷ��Խϴ����ǣ������������˲����㣬�Ҿ���һ����Σ���ԣ�Ŀǰ��������������Խ��������Ʒ���������ش�
�������ȼҵ����Ҫ��Ʒ֮һ����һ�ֳ��õ���������������ԭ������ˮ��Ӧ�����˴����Cl2+H2O?HCl+HClO��K=4.5��10-4���������ǿ��������ɱ��ˮ�еIJ�������ֱ���ô�����Ϊ����ˮ��������Ϊ�������ֽ⣬�Ҷ��Խϴ����ǣ������������˲����㣬�Ҿ���һ����Σ���ԣ�Ŀǰ��������������Խ��������Ʒ���������ش��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
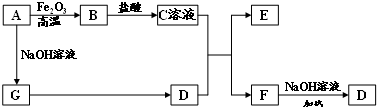
 ��ͼ��ʾ���ס���Ϊ������������أ�
��ͼ��ʾ���ס���Ϊ������������أ��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 25��ʱ����25mL 0.1mol?L-1NaOH��Һ����μ���0.2mol?L-1CH3COOH��Һ����ҺpH�仯������ͼ��ʾ�������йرȽ���ȷ���ǣ�������
25��ʱ����25mL 0.1mol?L-1NaOH��Һ����μ���0.2mol?L-1CH3COOH��Һ����ҺpH�仯������ͼ��ʾ�������йرȽ���ȷ���ǣ�������| A����A��B����һ�㣨����A��B�㣩����Һ��һ����c��Na+����c��CH3COO-����c��OH-����c��H+�� |
| B����B�㣬a=12.5������c��Na+��=c��CH3COO-����c��OH-��=c��H+�� |
| C����C�㣬c��Na+����c��CH3COO-����c��H+����c��OH-�� |
| D����D�㣬c��CH3COO-��+c��CH3COOH��=2c��Na+�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com