
【题目】下图是元素周期表的一部分,根据① ~ ⑧在周期表中的位置按题目要求回答:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
二 | ① | ② | ③ | |||||
三 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)元素① ~ ⑧中,化学性质最不活泼元素的原子结构示意图是___________。除⑧外,原子半径最大的是_______(填元素符号),元素⑦的氢化物的电子式是_____。
(2)①②③三种元素的气态氢化物的稳定性由强到弱的顺序是______(用相应氢化物的化学式作答)。元素①~⑧中的最高价氧化物对应的水化物中呈两性的氢氧化物是____________(填化学式),它与元素④的最高价氧化物对应的水化物的溶液反应的离子方程式是_________________________________________________________。
(3)某同学设计并进行实验,探究元素④⑤⑥金属性递变规律,请将实验报告补充完整。
实验步骤 | 实验现象 |
1.将一小块④的单质放入滴有酚酞溶液的冷水中 | _______________________________,发出嘶嘶响声,逐渐消失,溶液变成红色 |
2.将少量冷水注入盛有打磨过的⑤的单质的试管中,再滴加酚酞,一段时间后加热至沸腾 | 加热后________________ |
3.将2 mL 1 mol/L盐酸加入盛有打磨过的⑤的单质的试管中 | 剧烈反应,迅速产生大量无色气泡 |
4.将2 mL 1 mol/L盐酸加入盛有打磨过的______的试管中 | 反应缓慢,一段时间后,产生无色气泡 |
结论:Na、Mg、Al三种元素的金属性依次减弱 | |
【答案】 Ar Na
Na ![]() HF > NH3 > CH4 Al(OH)3 Al(OH)3 + OH—= AlO2—+ 2H2O 钠浮在水面上,熔成小球,四处游动 镁条表面产生无色气泡,溶液呈红色 铝片
HF > NH3 > CH4 Al(OH)3 Al(OH)3 + OH—= AlO2—+ 2H2O 钠浮在水面上,熔成小球,四处游动 镁条表面产生无色气泡,溶液呈红色 铝片
【解析】根据元素在周期表中的位置可知①~⑧元素分别是C、N、F、Na、Mg、Al、Cl、Ar。(1)元素① ~ ⑧中,化学性质最不活泼元素Ar元素的原子结构示意图是: ;同周期元素原子从左到右逐渐减小,同主族元素从上而下原子半径逐渐增大,故除⑧外,原子半径最大的是Na;元素⑦是氯元素,其氢化物的电子式是:
;同周期元素原子从左到右逐渐减小,同主族元素从上而下原子半径逐渐增大,故除⑧外,原子半径最大的是Na;元素⑦是氯元素,其氢化物的电子式是:![]() ;(2)C、N、F三种元素的气态氢化物的稳定性由强到弱的顺序是:HF > NH3 > CH4;元素①~⑧中的最高价氧化物对应的水化物中呈两性的氢氧化物是Al(OH)3;它与元素Na的最高价氧化物对应的水化物NaOH溶液反应的离子方程式是: Al(OH)3 + OH—= AlO2—+ 2H2O ;(3)1.钠与水反应生成氢氧化钠与氢气,钠的密度小于水,熔点较低,钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声,逐渐消失,溶液变成红色;2.镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,溶液呈浅红色;4.实验探究元素④⑤⑥金属性递变规律,故应是Al与盐酸反应;由金属与、水及酸的反应剧烈程度可知,Na、Mg、Al三种元素的金属性依次减弱。
;(2)C、N、F三种元素的气态氢化物的稳定性由强到弱的顺序是:HF > NH3 > CH4;元素①~⑧中的最高价氧化物对应的水化物中呈两性的氢氧化物是Al(OH)3;它与元素Na的最高价氧化物对应的水化物NaOH溶液反应的离子方程式是: Al(OH)3 + OH—= AlO2—+ 2H2O ;(3)1.钠与水反应生成氢氧化钠与氢气,钠的密度小于水,熔点较低,钠浮在水面上,熔成小球,四处游动,发出嘶嘶响声,逐渐消失,溶液变成红色;2.镁和滴有酚酞的沸水反应生成氢氧化镁和氢气,氢氧化镁在水中能电离出氢氧根离子使溶液呈碱性,但氢氧化镁的溶解性很小,溶液呈浅红色;4.实验探究元素④⑤⑥金属性递变规律,故应是Al与盐酸反应;由金属与、水及酸的反应剧烈程度可知,Na、Mg、Al三种元素的金属性依次减弱。


科目:高中化学 来源: 题型:
【题目】下列物质在空气中久置会发生变质,且在变质过程中,既有氧化还原反应发生,又有非氧化还原反应发生的是( )
A.氢氧化钠固体
B.氯化钠固体
C.金属钠
D.生石灰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液进行中和热的测定。
Ⅰ.配制0.50 mol·L-1 NaOH溶液
(1)若实验中大约要使用245 mL NaOH溶液,至少需要称量NaOH固体 g。
(2)从下图中选择称量NaOH固体所需要的仪器是 (填字母): 。
名称 | 托盘天平 (带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
仪器 |
|
|
|
|
|
|
序号 | a | b | c | d | e | f |
Ⅱ.测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示。

(4)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如表。
温度 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | 温度差 平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.6 | |
2 | 27.0 | 27.4 | 27.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
上表中的温度差平均值为 ℃
近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18 J·(g·℃)-1。则中和热ΔH= (取小数点后一位)。
③ 上述实验数值结果与57.3 kJ·mol-1有偏差,产生偏差的原因可能是(填字母) 。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)羟基的电子式_______;
(2)相对分子质量为72且沸点最低的烷烃的结构简式________;
(3)合成高聚物![]() 其单体的结构简式_______;
其单体的结构简式_______;
(4)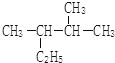 的名称(系统命名法)__________。
的名称(系统命名法)__________。
(5)甲烷具有_________________型的空间结构,而乙炔则具有_____________型空间结构。
(6)苯酚遇FeCl3溶液会显________色;蛋白质与浓硝酸共热会变________色;淀粉遇碘则显_____色。这些特性常被用于物质的检验或鉴别。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阅读下表中短周期主族元素的相关信息。
元素代号 | 相关信息 |
A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
B | B元素为地壳中含量最多的元素 |
C | 在第三周期元素中,C形成的简单离子半径最小 |
D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
E | 所有有机物中都含有E元素 |
请回答:
(1)C的简单离子的结构示意图:__________;
(2)X的化学式为__________;
(3)A、B、C三种元素形成的简单离子的半径由大到小的顺序为___________(用离子符号表示);
(4)EB2分子的电子式为:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下面是我们熟悉的物质(填序号):
①O2②SO2③CaCl2④HNO3⑤NaOH⑥NH4Cl
这些物质中,属于共价化合物的是___________;属于离子化合物的是___________;只含离子键的是___________。
(2)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。
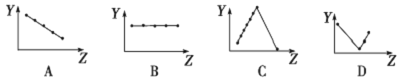
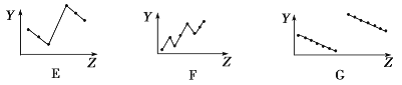
把与下面的元素有关性质相符的曲线的标号填入相应括号中:
①第ⅡA族元素的最外层电子数________________。
②第二、三周期主族元素随原子序数递增原子半径的变化____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程或现象与盐类水解无关的是
A. 纯碱溶液去油污
B. 小苏打溶液与AlCl3溶液混合产生气体和沉淀
C. 浓的硫化钠溶液有臭味
D. 加热稀醋酸溶液其pH 稍有减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com