
����Ŀ����ͼ��һ���绯ѧ���̵�ʾ��ͼ����ش��������⣺
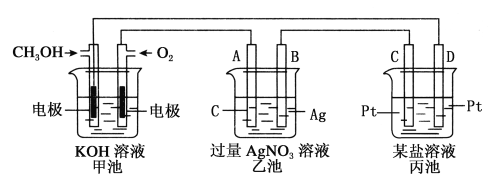
(1)ͼ�м׳���OH-����_________��������CH3OH������O2������
(2)д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ��__________________________________
(3)A�缫��������_____ �� �ҳ��з�Ӧ�Ļ�ѧ����ʽΪ_____________����Ҫʹ��Һ�ָ����ǰ��״̬��Ӧ���ҳ��м���________(д��ѧʽ)��
(4)���ҳ���B(Ag)����������10.8g���׳�������������O2�����Ϊ________L(��״��)����ʱ������ij�缫����ij������������е�ij����Һ������____________
A. MgSO4 B.CuSO4 C.NaCl D. AgNO3
���𰸡�CH3OH CH3OH��6e����8OH�� �� CO32����6H2O ���� 4AgNO3 + 2H2O ![]() 4HNO3 + 4Ag + O2�� Ag2O��Ag2CO3 0.56L BD
4HNO3 + 4Ag + O2�� Ag2O��Ag2CO3 0.56L BD
��������
��1���׳أ�ȼ�ϵ������ԭ��أ�ԭ��طŵ�ʱ����Һ���������������ƶ������������ƶ���
��2��ȼ�ϵ����ȼ��ʧ���ӷ���������Ӧ���״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ��
��3�����Դ���������Ľ��������ҳأ�����ӵ�Դ�ǵ��أ����������������ӷŵ磬�����������ӷŵ磬Ҫʹ��Һ�ָ�ԭ״�������������̼������
��4�����ݴ��������ת�Ƶ���������й�ϵʽ���㣬��Ϊ���أ���������Ԫ�أ������������������ݴ�ȷ�����еĽ���Ԫ�ء�
��1��ȼ�ϵ���ǻ�ѧ��ת��Ϊ���ܵ�װ�ã�����ԭ��أ�ȼ�ϵ���У�Ͷ��ȼ�ϵĵ缫�Ǹ�����Ͷ���������ĵ缫��������ԭ��طŵ�ʱ���������Һ���������������ƶ�������Ͷ�ż״��ĵ缫�ƶ���
�𰸣�CH3OH
��2����ȼ�ϵ���У��״�ʧ���Ӻ����������ӷ�Ӧ����̼������Ӻ�ˮ���缫��ӦʽΪ��CH3OH-6e-+8OH-=CO32-+6H2O��
�𰸣�CH3OH-6e-+8OH-=CO32-+6H2O��
��3���ҳ�����ӵ�Դ���ڵ��أ�����ԭ���������A������������ԭ��ظ�����B�������������������Һʱ��A�缫�����������ӷŵ磬B�缫�����ӷŵ磬�缫��Ӧʽ 4AgNO3 + 2H2O ![]() 4HNO3 + 4Ag + O2�������Ҫ��ָ�ԭ״������������������̼������
4HNO3 + 4Ag + O2�������Ҫ��ָ�ԭ״������������������̼������
�𰸣�4AgNO3 + 2H2O![]() 4HNO3 + 4Ag + O2�� Ag2O��Ag2CO3
4HNO3 + 4Ag + O2�� Ag2O��Ag2CO3
��4�����ݴ�����·ת�Ƶ���������й�ϵʽ
4e- ��4Ag �� O2
4��108g 22.4L
10.8g V��O2��
�����V��O2��=![]() L=0.56L��
L=0.56L��
�������������������ڽ������˳����н���Ԫ�ش���HԪ�غ���
A.����þ��þԪ�ش���HԪ��ǰ�����������ϲ������������ʣ���A����
B.�������ͭ��Һʱ������������ͭ����B��ȷ��
C.�Ȼ�������Ԫ�ش�����Ԫ��ǰ�����������ϲ������������ʣ���C����
D.�����������Һʱ������������������D��ȷ��
�𰸣� 0.56L BD


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Cu+HNO3 �������� Cu(NO3)2+NO��+4H2O��Ӧ�У�
(1) ______ Ԫ�ر������� ______ ����������
(2) ______ ��������� ______ ����������Ӧ��
(3)����ԭ��HNO3��μӷ�Ӧ��HNO3���ʵ���֮���� ______��
(4)��˫���ű���÷�Ӧ����ת�Ƶķ������Ŀ��
3Cu+8HNO3=3Cu(NO3)2+2NO��+4H2O _____________________________________��
(5)����8mol HNO3����ԭʱ����Ӧת��___________�����ӣ�
(6)д���÷�Ӧ�����ӷ�Ӧ����ʽ___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��������������ý�����ȷ����( )
ѡ�� | ʵ����� | ���� | ���� |
A | ��ij��ɫ��Һ�еμ�ϡ���� | ��Һ����� | ԭ��Һ��һ������ |
B | ��ij��ɫ��Һ�еμ�ϡNaOH��Һ | δ�۲쵽�������� | ԭ��Һ��һ�������� |
C | ������ | ��Һ�Ϻ�ɫ��ȥ |
|
D | ��ij��Һ��ͨ�� | ��Һ��� | ԭ��Һ��һ������ |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ҫ��Ⱦ��ΪSO2��NO��NO2��������ͼ���ս�������������������ա�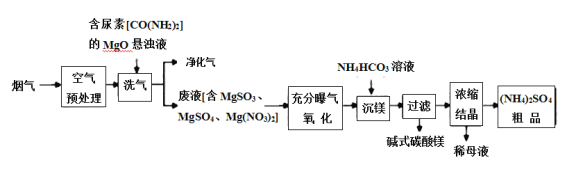
(1)����Ԥ���������У�������Ҫ��Ӧ�Ļ�ѧ����ʽΪ_______��
(2)ϴ�������У���������ԭ����ת������������Ⱦ������Ļ�ѧʽ��_______
(3)����������������У�������Ӧ�ĺ�þ��������_________��
(4)��ɳ�þ���������ɼ�ʽ̼��þ�����ӷ���ʽ___Mg2++____= MgCO3Mg(OH)2��+__CO2��+____H2O
(5)(NH4)2SO4��Ʒ�к��е���Ҫ����Ϊ_________(������)��
(6)��ʽ̼��þ�����ӹ���ѭ�����ã��ӹ����̷�����Ӧ�Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���������������Ͷ����������γ�����ʱ������еİ��йأ�����ͼ��ʾ�������������������
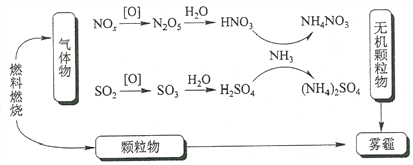
A. �������ķ�ɢ����ͬ
B. �����к�������狀������
C. NH3���γ���������Ĵ���
D. �������γ������ʩ�õ����й�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����仯������������;����ش��������⡣
![]() ��̬�����Ӽ۲���ӵĹ������ʽΪ____���������������ܼ��Ĺ����Ϊ____��
��̬�����Ӽ۲���ӵĹ������ʽΪ____���������������ܼ��Ĺ����Ϊ____��
![]() ������������������
������������������![]() ��
��![]() ��
��![]() ��
��![]() �ȣ��������ʵ��۵��ɸߵ��͵�˳������Ϊ__________��
�ȣ��������ʵ��۵��ɸߵ��͵�˳������Ϊ__________��
![]() ��Ǧ��
��Ǧ��![]() ����Ǧ
����Ǧ![]() ��һ�ֱȽϳ����Ŀ�����ܷ�ӦΪ��
��һ�ֱȽϳ����Ŀ�����ܷ�ӦΪ��![]() Ũ
Ũ![]() ����
����![]() ����λԭ����__________����һ������
����λԭ����__________����һ������![]() __________
__________![]() ����
����![]() ������
������![]() ������
������![]() ��
��![]() ��
��![]() ������ӻ���ʽΪ______________��������̬���ӵĿռ乹����
������ӻ���ʽΪ______________��������̬���ӵĿռ乹����![]() ��ͬ����__________��
��ͬ����__________��
A.SnCl2 B.SO3 ![]()
![]()
![]() ��Ǧ�������������ͼ��ʾ�������Ӳ�ȡ���������ѻ���Ǧ�����������������γɵ�__________��϶�С���֪�����ܶ�Ϊ��g��cm��3�������ӵ�������ֵΪ
��Ǧ�������������ͼ��ʾ�������Ӳ�ȡ���������ѻ���Ǧ�����������������γɵ�__________��϶�С���֪�����ܶ�Ϊ��g��cm��3�������ӵ�������ֵΪ![]() ��������������Ǧ��������ľ���Ϊ__________nm��
��������������Ǧ��������ľ���Ϊ__________nm��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͼ1��ͭпԭ���ʾ��ͼ��ͼ2�У�x���ʾʵ��ʱ���������ĵ��ӵ����ʵ�����y���ʾ��������
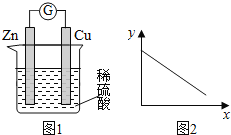
A. ͭ�������� B. c(Zn2��) C. c(H��) D. c(SO42-) -
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊ��ʽ���ڱ���һ���֣����еı�Ŵ�����Ӧ��Ԫ�ء�
�� | |||||||||||||||||
�� | �� | ||||||||||||||||
�� | �� | �� | �� | �� | |||||||||||||
�� | �� |
��ش��������⣺
(1)���Т������______ ��Ԫ�ء�
(2)����Ԫ�آ۵�2��ԭ����Ԫ�آٵ�2��ԭ���γɵ�ij��ֱ���ͷ�������Ϊ ________ �� �ۺ͢��γɵ�һ�ֳ����ܼ������������ռ乹��Ϊ________ ��
(3)Ԫ�آٺ͢��γɵ������X���� ________ ����(���������������Ǽ�����)��
(4)Ԫ�آĵ�һ������ ________ Ԫ�آߵĵ�һ�����ܣ�Ԫ�آڵĵ縺��________ Ԫ�آܵĵ縺��(ѡ����>��������������<��)��
(5)Ԫ�آ�Ļ�̬ԭ�Ӻ���۵����Ų�ʽ�� ________ ��
(6)Ԫ�آ�͢��γɵĻ�����ĵ���ʽΪ ________ ��
(7)ijЩ��ͬ��Ԫ�ص�����Ҳ��һ���������ԣ����ϱ���Ԫ�آ���Ԫ�آݵ��������������Ƶ����ʡ���д��Ԫ�آ������������NaOH��Һ��Ӧ�Ļ�ѧ����ʽ��________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���ش��������⣺
���� ���� | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
�� | �� | �� | �� | |||||
�� | �� | �� | �� | �� | �� | |||
�� | �� | �� |
��1������ЩԪ���У�����õķǽ���Ԫ����___��Ԫ�ط��ţ���ԭ�������ﵽ�ȶ��ṹ��Ԫ����__��Ԫ�ط��ţ���
��2��Ԫ�ص�����������Ӧ��ˮ������������ǿ����____���ѧʽ����
��3��д���ܵ���������۵�����������Ӧ��ˮ�������Ӧ�Ļ�ѧ����ʽ_____��
��4���ۡ��ޡ����ԭ�Ӱ뾶�ɴ�СΪ__��___��__/span>����Ԫ�ط��ţ��١��ݵ���ۺ���������__��__�����ѧʽ����
��5��д��֤���ǽ����ԢޱȢ�ǿ�����û���Ӧ֤�����Ļ�ѧ����ʽ________��
��6��д��ʵ�����Ʊ�����⻯��Ļ�ѧ����ʽ_________��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com