
【题目】下列有关实验方案或说法正确的是
A.  实验室制取乙酸乙酯
实验室制取乙酸乙酯
B.  比较NaHCO3和Na2CO3的热稳定性
比较NaHCO3和Na2CO3的热稳定性
C.  脱脂棉燃烧证明过氧化钠与水反应放热
脱脂棉燃烧证明过氧化钠与水反应放热
D.  a处有红色物质生成,b处变蓝,证明X一定是H2
a处有红色物质生成,b处变蓝,证明X一定是H2
【答案】C
【解析】
A、为防止倒吸,右端的导管不能深入液面以下,应在靠近液面的上方,故A错误;
B、"套管实验"中外管的温度高,内管温度低,若外管盛放碳酸钠,内管盛放碳酸氢钠,内管连接的澄清石灰水首先出现浑浊时,则说明NaHCO3的稳定性弱于Na2CO3,故B错误;
C、一般燃烧,需要氧气和温度达到着火点,过氧化钠与H2O反应2Na2O2+2H2O=4NaOH+O2↑,脱脂棉燃烧,说明过氧化钠与水反应生成O2,且该反应为放热反应,故C正确;
D、a处有红色物质生成,说明氧化铜转化成Cu,无水硫酸铜变蓝,说明有水生成,X可能是NH3、CH4,也可能是H2、或H2和CO的混合物等,故D错误。


 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】![]() 为阿伏加德罗常数的值。下列说法正确的是
为阿伏加德罗常数的值。下列说法正确的是
A. 0.1 mol 的![]() 中,含有
中,含有![]() 个中子
个中子
B. pH=1的H3PO4溶液中,含有![]() 个
个![]()
C. 2.24L(标准状况)苯在O2中完全燃烧,得到![]() 个CO2分子
个CO2分子
D. 密闭容器中1 mol PCl3与1 mol Cl2反应制备 PCl5(g),增加![]() 个P-Cl键
个P-Cl键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式正确的是( )
A. 用稀硫酸除去硫酸钠溶液中少量的硫代硫酸钠:Na2S2O3+2H+=SO2↑+S↓+2Na++H2O
B. 氢氧化亚铁暴露于空气中会变色:4Fe(OH)2+O2+2H2O=4Fe(OH)3
C. 向Ca(ClO)2溶液中通入过量CO2制取次氯酸: Ca2++ClO-+H2O+CO2=2HClO+CaCO3↓
D. 氯气用于自来水消毒:Cl2 + H2O![]() 2H+ + Cl-+ ClO-
2H+ + Cl-+ ClO-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与化学有关的文献,理解正确的是
A. 《石灰吟》中“…烈火焚烧若等闲…要留清白在人间”,其中“清白”指氢氧化钙
B. 《咏煤炭》中“凿开混沌得乌金…不辞辛苦出山林”,其中“乌金”的主要成分是木炭
C. 《本草纲目》中“冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”,其中的“碱”是一种盐溶液
D. 《天工开物》中有如下描述:“世间丝、麻、裘、褐皆具素质…”文中的“丝”“麻”、“裘”主要成分均属于多糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碘在地壳中主要以NaIO3的形式存在,在海水中主要以I-的形式存在,几种微粒之间的转化关系如图所示。已知:淀粉遇单质碘变蓝。下列说法中,不正确的是
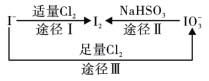
A. 氧化性的强弱顺序为:Cl2 >IO3- >I2
B. 一定条件下, I-与IO3-反应可能生成I2
C. 途径Ⅱ中若生成1mol I2,消耗4mol NaHSO3
D. 向含I-的溶液中通入Cl2,所得溶液加入淀粉溶液不一定变为蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氟碳铈矿(主要成分为CeFCO3)是提取稀土化合物、冶炼铈的重要矿物原料,以氟碳铈矿为原料提取铈的工艺流程如图所示。回答下列问题:

(1)CeFCO3中Ce的化合价为______。
(2)氧化焙烧后的产物之一为CeO2,则酸浸时发生反应的离子方程式为________。
(3)HT是一种难溶于水的有机溶剂,则操作Ⅰ的名称为_____。
(4)为了提高酸浸率,可以适当提高反应温度,但温度偏高浸出率反而会减小,其原因是___________。
(5)有机物HT能将Ce3+从水溶液中提取出来,该过程可表示为Ce3+ (水层)+3HT(有机层)![]() CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:_________。
CeT3 (有机层)+3H+ (水层)。向CeT3(有机层)中加入稀硫酸能获得较纯的含Ce3+水溶液,从平衡角度解释其原因:_________。
(6)已知,298K时,Ksp[Ce(OH)3]=5×l0-20,若溶液中c(Ce3+)=0.05mol·L-1,加碱调节pH到_____时Ce3+开始沉淀(忽略加碱过程中溶液体积变化)。
(7) 写出向Ce(OH)3悬浊液中通入氧气得到产品Ce(OH)4的化学方程式:_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W、Z位于同主族,四种元素组成的一种化合物的结构式为 。下列说法不正确的是
。下列说法不正确的是
A. W的最简单氢化物的稳定性比X的弱
B. X.Y形成的化合物水溶液显碱性
C. W与Y形成的化合物中一定含有离子键
D. 原子半径:Y>Z>X>W
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)普通锌锰干电池的结构如图所示。回答下列问题。

①电池中电解质溶液为___。
②负极反应式为___,放电时正极(碳棒)上发生反应的物质是___。
③放电时,NH4+向___ (填“正极”或“负极”)移动。
(2)废电池中的锌皮常用于实验室制氢气,废锌皮和纯锌粒分别与同浓度的稀硫酸反应,产生氢气速率较大的是___,原因是___。
若用过量的纯锌粒与一定量的稀硫酸反应,为了加快反应速率又不影响产生氢气的量,下列措施可行的是___(填字母)。
A.微热
B.加入适量氧化铜
C.加入少量硫酸铜溶液
D.加水
E.加入少量氢氧化钡溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com