
【题目】一定条件下进行反应:COCl2(g)![]() Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
Cl2(g)+CO(g)。向2.0 L恒容密闭容器中充入1.0 mol COCl2(g),经过一段时间后达到平衡。反应过程中测得的有关数据见下表:
t/s | 0 | 2 | 4 | 6 | 8 |
n(Cl2)/mol | 0 | 0.30 | 0.39 | 0.40 | 0.40 |
下列说法正确的是( )
A.保持其他条件不变,升高温度,平衡时c(Cl2)=0.22 mol·L-1,则反应的ΔH<0
B.若在2 L恒容绝热(与外界没有热量交换)密闭容器进行该反应,化学平衡常数不变
C.保持其他条件不变,起始向容器中充入1.2 mol COCl2、0.60 mol Cl2和0.60 mol CO,反应达到平衡前的速率:v(正)>v(逆)
D.保持其他条件不变,起始向容器中充入1.0 mol Cl2和0.8 mol CO,达到平衡时,Cl2的转化率小于60%
【答案】D
【解析】
试题分析:A.由表中数据可知,6s、8s时氯气的物质的量都是0.4mol,说明6s时反应到达平衡,平衡时氯气的浓度为0.2mol.L,升高温度,到达新平衡,氯气的浓度变为0.22mol/L,氯气浓度增大,说明平衡向正反应方向移动,故正反应为吸热反应,即△H>0,故A错误;B.正反应为吸热反应,恒容绝热密闭容器进行该反应,随反应进行温度降低,而平衡常数只受温度影响,故平衡常数一定发生变化,故B错误;C.平衡时c(Cl2)=0.2mol/L,
COCl2(g)![]() Cl2(g)+CO(g)
Cl2(g)+CO(g)
起始(mol/L):0.5 0 0
转化(mol/L):0.2 0.2 0.2
平衡(mol/L):0.3 0.2 0.2
该温度下平衡常数k=![]() =0.013,
=0.013,
若起始向容器中充入1.2 molCOCl2、0.60 molCl2和0.60 molCO,此时Qc=![]() =0.15>0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C错误;D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=
=0.15>0.13,则反应向逆反应方向移动,反应达到平衡前v正<v逆,故C错误;D.原平衡等效为起始向容器中充入1.0molCl2和1.0molCO,达到平衡时Cl2的转化率=![]() ×100%=60%,如加入1.0 mol Cl2和0.8 mol CO,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小,则Cl2的转化率小于60%,故D正确,故选D。
×100%=60%,如加入1.0 mol Cl2和0.8 mol CO,相当于在原来的基础上减小0.2molCO,平衡在原来的基础上向正反应方向移动,则Cl2的转化率减小,则Cl2的转化率小于60%,故D正确,故选D。


 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】【化学--选修物质结构与性质】
信息一:铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
信息二:氯化铬酰(CrO2Cl2)是铬的一种化合物,常温下该化合物是暗红色液体,熔点为﹣96.5℃,沸点为117℃,能和丙酮(CH3COCH3)、四氯化碳、CS2等有机溶剂互溶。
(1)写出Fe(26号元素)原子的基态电子排布式为 。
(2)CH3COCH3分子中含有 个π键,含有 个δ键。
(3)固态氯化铬酰属于 晶体,丙酮中碳原子的杂化方式为 ,二硫化碳属于 (填极性”或“非极性”)分子。
(4)K[Cr(C2O4)2(H2O)2]也是铬的一种化合物,该化合物属于离子化合物,其中除含离子键、共价键外,还含有有 键。
(5)金属铬的晶胞如下图所示,一个晶胞中含有 个铬原子。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水热法制备Fe2O3纳米颗粒的反应是3Fe2++2S2O32-+O2+xOH-=Fe3O4+S4O62-+2H2O,关于该反应下列说法正确的是
A.H2O和S4O62-都是还原产物
B.1molFe2+参加反应时,转移2mol电子
C.Fe2+、S2O32-都是还原剂
D.x=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)
增大,应加入的物质或采取的措施是
①NH4Cl固体,②硫酸,③NaOH固体,④水,⑤加热,⑥加入少量MgSO4固体
A、①②③⑤ B、③ C、③⑥ D、③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】密闭容器中发生如下反应:A(g)+3B(g)![]() 2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
2C(g) ΔH<0,根据下列速率—时间图像,回答下列问题。
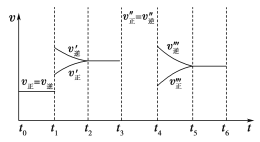
(1)下列时刻所改变的外界条件是:
t1________;t3________;t4________;
(2)物质A的体积分数最大的时间段是________________;
(3)上述图像中C的体积分数相等的时间段是________________;
(4)反应速率最大的时间段是________________。
(5)t0~t1、t3~t4、t5~t6时间段的平衡常数K0、K3、K5的关系________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子或分子在指定溶液中可能大量共存的是
A.pH=7的溶液:Fe3+、NH4+、Cl-、NO3-
B.水电离出的c(H+)=1.0×10-12mol·L-1的溶液中:Na+、SO42-、HCO3-、K+
C.由水电离出的c(OH-)=1.0×10-2mol·L-1的溶液:Cl-、CH3COO-、K+、[Al(OH)4]-
D.![]() =1012的溶液中,NH4+、Al3+、NO3-、Cl-
=1012的溶液中,NH4+、Al3+、NO3-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质)制备七水合硫酸亚铁(FeSO4·7H2O),设计了如下流程:
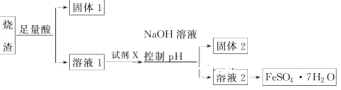
下列说法不正确的是
A.溶解烧渣选用足量硫酸,试剂X选用铁粉
B.固体1中一定有SiO2,控制pH是为了使Al3+转化为Al(OH)3进入固体2
C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解
D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组微粒能大量共存,当加入相应试剂后会发生化学变化,且发生反应的离子方程式书写正确的是 ( )
选项 | 微粒组 | 所加试剂 | 离子方程式 |
A | NH | 少量Ba(OH)2溶液 | 2NH = BaSO4↓+NH3·H2O |
B | Mg2+、HCO | 过量NaOH溶液 | Mg2++2HCO = MgCO |
C | H+、Na+、NO | Fe粉 | Fe+2H+= Fe2++H2↑ |
D | Ca2+、NH3·H2O、Cl- | 通入过量CO2 | NH3·H2O+CO2 = NH |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,取20mL某浓度的HCl作为待测液,用一定物质的量浓度的NaOH溶液进行滴定(假设盐酸与NaOH溶液混合后体积变化忽略不计),滴定过程中溶液的pH变化如右图所示。下列叙述正确的是
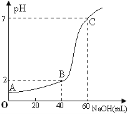
A.所用HCl的浓度是0.09mol·L─1,NaOH溶液浓度为0.03mol·L─1
B.在B点,溶液中离子浓度关系为:c(Cl─)>c(H+)>c(Na+)>c(OH─)
C.A、B、C三点由水的电离产生的c(H+)大小依次为:A>B>C
D.滴定前,锥形瓶用待测液润洗,导致HCl浓度偏低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com