
 .
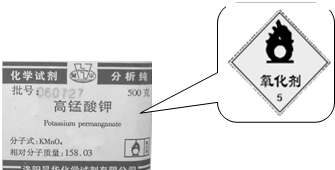
. 分析 (1)由所贴的标志可知高锰酸钾为强氧化剂,具有强氧化性;
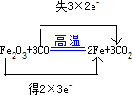
(2)Fe、Fe2+、Fe3+这三种微观粒子中,只具有还原性的元素化合价应为最低价,赤铁矿和CO在高温下发生反应生成铁和二氧化碳,铁元素化合价由+3价降低到0价,C元素化合价由+2价升高到+4价.
解答 解:(1)由所贴的标志可知高锰酸钾为强氧化剂,具有强氧化性,只有D被氧化,故答案为:氧化; D;
(2)Fe、Fe2+、Fe3+这三种微观粒子中,只具有还原性的元素化合价应为最低价,只具有还原性,该反应中元素化合价的变化分别是:Fe元素+3→0价,C元素+2→+4价,所以氧化剂是Fe2O3,还原剂是CO,碳元素被氧化,铁元素被还原;该反应中,Fe元素的化合价由+3降低为0,得2×3e-,C元素的化合价由+2升高到+4,失3×2e-,则用“双线桥法”表示反应中电子转移的方向和总数为 ,
,
故答案为:Fe; .
.
点评 本题考查氧化还原反应,为高频考点,把握电子守恒、原子守恒得到反应方程式为解答的关键,注意反应中量的关系及转移电子数,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,2gD2O中含有的电子总数为NA | |
| B. | 高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA | |
| C. | 1mol K与足量O2反应,生成K2O、K2O2和KO2的混合物时转移的电子数为NA | |
| D. | 室温下,1 L pH=13的NaOH溶液中,由水电离的OH-数目为10-13NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤⑥ | B. | ①②③④⑤ | C. | ①②③④ | D. | ①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | |
| C | D |
| 化学键 | H-H | Br-Br | H-Br |
| 键能(kJ/mol) | 436 | 194 | 362 |
| 化学式 | Ag2SO4 | AgBr |
| 溶解度(g) | 0.796 | 8.4×10-6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硅与苛性钠反应:SiO2+2OH-═SiO32-+H2O | |
| B. | 在NaCl溶液中滴入AgNO3试液:Ag++Cl-═AgCl↓ | |
| C. | Cl2溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| D. | 用NaOH溶液吸收Cl2:Cl2+2OH-═Cl-+ClO-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下:
乙酰苯胺是常用的医药中间体,可由苯胺与乙酸制备.反应的化学方程式如下: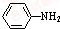 (苯胺)+CH3COOH?
(苯胺)+CH3COOH? (乙酸苯胺)+H2O
(乙酸苯胺)+H2O| 化合物 | 密度(g.cm-3) | 溶解性 | 熔点(℃) | 沸点(℃) |
| 乙酸 | 1.05 | 易溶于水、乙醇 | 17 | 118 |
| 苯胺 | 1.02 | 微溶于水,易溶于乙醇 | -6 | 184 |
| 乙酰苯胺 | - | 微溶于冷水,可溶于热水,易溶于乙醇 | 114 | 304 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯的结构简式CH2CH2 | |
| B. | 化学名词:乙酸乙脂、笨、油酯、坩埚 | |
| C. | 如图是某一种物质的结构简式是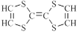 ,则该物质是一种烃 ,则该物质是一种烃 | |
| D. | 聚乙烯的化学组成表示式为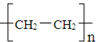 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com