
【题目】将24.0gNaOH固体溶于水配成100mL溶液,其密度为1.20g﹒mL-1。试计算:.
(1)该溶液中NaOH的物质的量浓度为______。
(2)该溶液中NaOH的质量分数为______。。
(3)从该溶液中取出10mL,其中含NaOH的质量为___。
(4)将取出的10mL溶液加水稀释到100mL,稀释后溶液中NaOH的物质的量浓度为______。
科目:高中化学 来源: 题型:
【题目】采用下列装置和操作,能达到实验目的的是( )
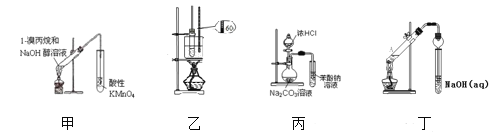
A. 装置甲可用于检验1—溴丙烷的消去产物B. 装置乙用于实验室制硝基苯
C. 装置丙可证明酸性:盐酸>碳酸>苯酚D. 装置丁用于制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )
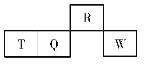
A.最高价氧化物对应水化物的酸性:Q<W
B.最简单气态氢化物的热稳定性:R>Q
C.原子半径:T>Q>R
D.含T的盐中,T元素只能存在于阳离子中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.在常温常压下,11.2L Cl2含有的分子数为0.5NA
B.25℃,1.01×105Pa,64gSO2中含有的原子数为3NA
C.标准状况下,11.2LH2O含有的电子数为5NA
D.常温下,28gN2和CO混合气体中原子个数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.碳酸钠的水解反应CO32-+H2O=HCO3-+OH -
B.碳酸氢钙与过量的NaOH溶液反应Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.苯酚钠溶液与二氧化碳反应C6H5O-+CO2+H2O=C6H5OH+CO32-
D.稀硝酸与过量的铁屑反应3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是将铁离子引入到活性硅酸而制得的复合型混凝剂。用废铁皮(主要成分Fe和Fe3O4,少量碳)为原料制备的流程如下:
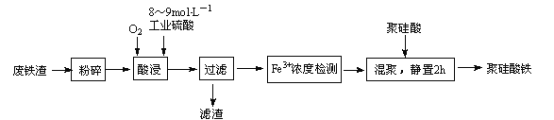
(1)废铁渣进行“粉碎”的目的是_________________。
(2)在实验室进行过滤操作时,所用到玻璃仪器有___________________________。
(3)“酸浸”需适宜的酸浓度、液固比、酸浸温度、氧流量等条件,其中酸浸温度对铁浸取率的影响如下表所示:
温度(℃) | 40 | 60 | 80 | 100 | 120 |
铁浸取率(%) | 50 | 62 | 79 | 92 | 83 |
已知:在一定温度下,Fe3+在pH=2开始沉淀,pH=3.7沉淀完全。
①酸浸时应控制溶液的pH___________
②酸浸时通入O2的目的是_______________________________。
③当酸浸温度超过100℃时,铁浸取率反而减小,其原因是__________________________。
(4)滤渣的主要成分为____________________________(填化学式)。
(5)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-被还原为Cr3+),该滴定反应的离子方程式为_________________________;
已知称取2.60 g聚硅酸铁产品,加入硫酸,再加入足量SnCl2,用0.2000 mol/L K2Cr2O7标准溶液滴定,消耗K2Cr2O7溶液的体积为20.00 mL,则聚硅酸铁产品中铁元素的百分含量为_____________________(结果保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石。晶体硅(熔点1410℃)用途广泛,制取与提纯方法有多种。
(1)炼钢开始和结束阶段都可能发生反应: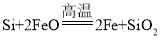 ,其目的是________。
,其目的是________。
A.得到副产品硅酸盐水泥 B.制取SiO2,提升钢的硬度
C.除去生铁中过多的Si杂质 D.除过量FeO,防止钢变脆
(2)一种由粗硅制纯硅过程如下:![]() 在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
在上述由SiCl4制纯硅的反应中,测得每生成1.12kg纯硅需吸收akJ热量,写出该反应的热化学方程式:_______。对于钠的卤化物(NaX)和硅的卤化物(SiX4)下列叙述正确的是(_________)
A.NaX易水解 B.SiX4是共价化合物
C.NaX的熔点一般高于SiX4 D.SiF4晶体是由共价键形成的空间网状结构
(3)粗硅经系列反应可生成硅烷(SiH4),硅烷分解也可以生成高纯硅。硅烷的热稳定性弱于甲烷, 所以Si元素的非金属性弱于C元素,用原子结构解释其原因:_______。
(4)此外,还可以将粗硅转化成三氯氢硅(SiHCl3),通过反应:SiHCl3(g)+H2(g)![]() Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
Si(s)+3HCl(g)制得高纯硅。不同温度下,SiHCl3的平衡转化率随反应物的投料比(反应初始时,各反应物的物质的量之比)的变化关系如图所示。下列说法正确的是(__________)(填字母序号)。
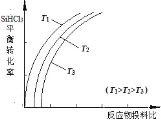
a.该反应的平衡常数随温度升高而增大
b.横坐标表示的投料比应该是![]()
c.实际生产中为提高SiHCl3的利用率,可适当降低压强
(5)硅元素最高价氧化物对应的水化物是H2SiO3。室温下,0.1mol/L的硅酸钠溶液和0.1mol/L的碳酸钠溶液,碱性更强的是_______,其原因是_______。
已知:H2SiO3:Ki1=2.0×10-10,Ki2=1.0×10-12;H2CO3:Ki1=4.3×10-7,Ki2=5.6×10-11。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在探究影响化学反应速率的因素时,将H2C2O4溶液滴入KMnO4酸性溶液中,一段时间后,溶液突然变成无色,发生反应:KMnO4+H2C2O4+H2SO4![]() K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
K2SO4+MnSO4+CO2+H2O(没有配平)。下列有关说法错误的是
A. H2C2O4中C的化合价为+3
B. 每生成22.4 L(标况)CO2,转移电子2 mol
C. 该反应中,氧化剂与还原剂物质的量之比为2 :5
D. 溶液突然褪色的原因是产物MnSO4对该反应有催化作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某原电池装置如图所示,电池总反应为 2Ag + Cl2 = 2AgCl。已知阳离子交换膜只允许阳离子通过,阴离子不能通过,离子交换过程中溶液电荷守恒。下列说法正确的是
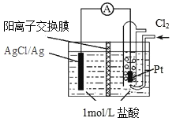
A.正极反应式为 AgCl + e—= Ag + Cl—
B.放电时,交换膜右侧溶液中有大量白色沉淀生成
C.若用 NaCl 溶液代替盐酸,则电池总反应随之改变
D.当外电路中转移 0.1mol e—时,阳离子交换膜左侧溶液中约减少0.2mol 离子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com