
【题目】重铬酸钾(K2Cr2O7)是高中化学常见的氧化剂,工业上以铬铁矿为原料用碱溶氧化法制备。铬铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等。
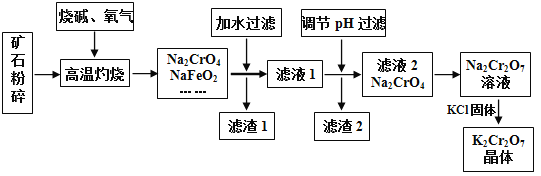
已知:①NaFeO2遇水强烈水解②2CrO42-(黄色) + 2H+![]() Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
请回答下列问题:
(1)将矿石粉碎的目的是________;高温灼烧时Cr2O3发生反应的化学方程式为__________。
(2)滤渣1中有红褐色物质,写出生成该物质反应的离子方程式________。滤渣2的主要成分是A1(OH)3和______________。
(3)用简要的文字说明Na2Cr2O7溶液中加入KC1固体,降温析出K2Cr2O7的原因_______。
(4)25°C时,对反应2CrO42-(黄色)+2H+![]() Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
Cr2O72- (橙色)+H2O,取Na2CrO4溶液进行实验,测得部分实验数据如下:
时间/ (S) | 0 | 0.01 | 0.02 | 003 | 0.04 |
(CrO42-)/ (mol·L-1) | 0.20 | 1.6×10-2 | 1.2×10-2 | 1.0×10-2 | |
(Cr2O72-)/ (mol·L-1) | 0 | 9.2×l0-2 | 9.4×10-2 | 9.5×10-2 |
反应达到平衡时,溶液的pH=l,该反应平衡常数K为______。
②下列有关说法正确的_____________。
a.加少量NaHCO3固体,可使溶液的橙色加深
b.0.03 s时v(CrO42-)(正)=2v(Cr2O72-)(逆)
c.溶液中c(CrO42-):c(Cr2O72-)=2 : 1时该反应己达平衡状态
d.反应达到平衡时CrO42-的转化率为95%
【答案】 增大反应物的表面积,加快反应速率 2Cr2O3 +3O2+8NaOH![]() 4Na2CrO4+4H2O FeO2-+2H2O=Fe(OH)3↓+OH- H2SiO3 K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小 9.5×104 bd
4Na2CrO4+4H2O FeO2-+2H2O=Fe(OH)3↓+OH- H2SiO3 K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小 9.5×104 bd
【解析】铁矿中通常含有Cr2O3、FeO、Al2O3、SiO2等,将铬铁矿和烧碱、氧气混合焙烧得到Na2CrO4、NaFeO2,而SiO2与NaOH发生反应生成Na2SiO3,Al2O3与NaOH发生反应,生成NaAlO2,故还含有Na2SiO3、NaAlO2,由于NaFeO2会发生强烈水解生成氢氧化钠与氢氧化铁,过滤分离,滤液1中主要是NaAlO2、Na2SiO3、Na2CrO4、NaOH,滤渣1为Fe(OH)3;调节溶液pH,使NaAlO2、Na2SiO3反应转化为H2SiO3、Al(OH)3沉淀,过滤除去,滤液2主要是Na2CrO4,加入硫酸酸化,溶质变为Na2Cr2O7,然后加入KCl固体,利用溶解度不同或者受温度影响不同,结晶得到K2Cr2O7晶体,采用过滤方法得到K2Cr2O7晶体,据此分析解答。
(1)将矿石粉碎的目的是:增大反应物的表面积,加快反应速率;高温时发生氧化还原反应,Cr2O3与O2、NaOH反应生成Na2CrO4与水,反应方程式为:2Cr2O3+3O2+8NaOH![]() 4Na2CrO4+4H2O;(2)NaFeO2会发生强烈水解生成氢氧化钠与氢氧化铁,反应离子方程式为:FeO2-+2H2O=Fe(OH)3↓+OH-;滤渣2的主要成分是A1(OH)3和H2SiO3;(3)Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因:K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
4Na2CrO4+4H2O;(2)NaFeO2会发生强烈水解生成氢氧化钠与氢氧化铁,反应离子方程式为:FeO2-+2H2O=Fe(OH)3↓+OH-;滤渣2的主要成分是A1(OH)3和H2SiO3;(3)Na2Cr2O7溶液中加入KCl固体,降温析出K2Cr2O7的原因:K2Cr2O7的溶解度受温度影响较大,氯化钠的溶解度受温度影响较小;
(4)①0.03s时c(Cr2O72-)=1/2×(0.2-1.0×10-2)mol/L=9.5×10-2mol/L,与0.04s时的浓度相等,故0.03s时处于平衡状态,反应达到平衡时,溶液的pH=1,该反应平衡常数K=c(Cr2O72)/c2(CrO42)×c2(H+) =9.5×102/(1.0×102)2×0.12=9.5×104;②a.加少量NaHCO3固体,消耗氢离子,平衡逆向移动,溶液的橙色变浅,黄色加深,a错误;b.0.03s时处于平衡状态,v(CrO42)(正)=2v(Cr2O72)(逆)说明同种离子的生成速率与消耗速率相等,b正确;c.平衡时各组分的浓度不一定等于化学计量数之比,与转化率等有关,c错误;d.反应达到平衡时CrO42-的转化率为(21.0×102)mol/L/0.2mol/L×100%=95%,d正确,答案选bd。


科目:高中化学 来源: 题型:
【题目】胶体区别于其它分散系的本质特征是( )
A.胶体是一种介稳性的分散系
B.胶体粒子带电荷
C.胶体粒子直径在1﹣100nm之间
D.光束通过胶体时有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.失去电子的是还原剂,表现氧化性
B.氧化还原反应的本质是元素化合价的升降
C.阳离子只有氧化性,阴离子只有还原性
D.氧化还原反应中,某元素由化合物变为单质,此元素可能被还原,也可能被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(16分) W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)X的硝酸盐水溶液显 性,用离子方程式解释原因: 。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为 。
(5)比较Y、Z气态氢化物的稳定性: > (用分子式表示)。
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是 > > > 。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出QkJ的热量。写出该反应的热化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知可逆反应CO(g)+H2O(g)![]() CO2(g)+H2(g),达到平衡时。
CO2(g)+H2(g),达到平衡时。
(1)830K时,若起始时:c(CO)=2mol/L,c(H2O)=3mol/L,平衡时CO的转化率为60%,水蒸气的转化率为____________;K值为_________。
(2)830K,若只将起始时c(H2O)改为6mol/L,其他条件不变,则水蒸气的转化率为____________。
(3)若830K时,起始浓度c(CO)=a mol/L,c(H2O)=b mol/L,H2的平衡浓度c(H2)=c mol/L,a、b、c之间的关系式是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新药的开发及药物合成是有机化学研究重要发展方向,某药物V的合成路线如下:

(1)Ⅱ中含氧官能团的名称 。
(2)反应②的化学方程式
(3)Ⅰ和Ⅲ在浓硫酸催化加热时反应的化学方程式
(4)下列说法正确的是
A.Ⅰ和Ⅴ均属于芳香烃 B.Ⅱ能发生银镜反应
C.1molⅡ能与4molH2发生加成反应 D.反应③属于酯化反应
(5)反应③的反应类型 反应;A的分子式
(6)Ⅵ与Ⅰ互为同分异构体,Ⅵ遇FeCl3发生显色反应,其苯环上的一氯代物只有2种。
 写出满足上述条件的Ⅵ的结构简式
写出满足上述条件的Ⅵ的结构简式
(7)反应④的反应类型是 反应;一定条件下,化合物Ⅶ也能发生类似反应④的环化反应,Ⅶ的环化产物的结构简式
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示( )
①c(Ag+) ②c(NO3-) ③a棒的质量 ④b棒的质量 ⑤溶液的质量
A. ① ③ B. ③ ④ C. ① ② ④ D. ②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“纳米材料”是粒子直径为几纳米至几十纳米的材料,纳米碳就是其中一种.若将纳米碳均匀地分散到蒸馏水中,对形成的物质的描述正确的是( ) ①是溶液 ②是胶体 ③能产生丁达尔效应 ④能透过半透膜 ⑤不能透过半透膜
⑥能透过滤纸 ⑦不能透过滤纸 ⑧静置后会析出黑色沉淀.
A.①⑤⑦⑧
B.②③④⑦
C.②③⑤⑥
D.①④⑥⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L-1盐酸倒入小烧杯中,测出盐酸温度;
②用另一量筒量取50 mL 0.55 mol·L-1NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量? 。
(2)倒入NaOH溶液的正确操作是 (填序号)。
A.沿玻璃棒缓慢倒入
B.分三次少量倒入
C.一次迅速倒入
(3)使盐酸与NaOH溶液混合均匀的正确操作是 (填序号)。
A.用温度计小心搅拌
B.揭开硬纸片用玻璃棒搅拌
C.轻轻地振荡烧杯
D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 mol·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为 。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1· ℃-1。为了计算中和热,某学生实验记录数据如下:
实验序号 | 起始温度t1/ ℃ | 终止温度t2/ ℃ | |
盐酸 | 氢氧化钠溶液 | 混合溶液 | |
1 | 20.0 | 20.1 | 23.2 |
2 | 20.2 | 20.4 | 23.4 |
3 | 20.5 | 20.6 | 23.6 |
依据该学生的实验数据计算,该实验测得的中和热ΔH= (结果保留一位小数)。
(6) (填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com