
| A、用稀硫酸和锌粒制氢气 |
| B、用氯酸钾和二氧化锰加热制氧气 |
| C、用浓盐酸和漂白粉共热制氯气 |
| D、用石灰石和稀盐酸制二氧化碳 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
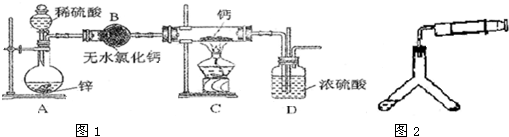
| 48.06 |
| 22400 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、其它条件不变时,升高温度化学反应速率加快 |
| B、其它条件不变时,增大浓度化学反应速率加快 |
| C、当反应物的浓度与生成物的浓度相等时,化学反应达到化学平衡 |
| D、当正反应的速率与逆反应的速率相等时,化学反应达到化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二氯甲烷有两种同分异构体 |
| B、苯和苯的同系物均能使高锰酸钾酸性溶液褪色 |
| C、醇发生脱水反应一定生成含C=C双键的化合物 |
| D、一定条件下溴乙烷既能发生取代反应又能发生消去反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11.2LO2所含的分子数目为0.5NA |
| B、44gCO2所含的原子数目为NA |
| C、1L1.00mol?L-1Na2CO3溶液中Na+离子数目为2NA |
| D、1molFe与足量盐酸完全反应,Fe失去的电子数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、Cl-、Br- |
| B、Ba2+、OH-、SO42- |
| C、Cu2+、Fe3+、OH- |
| D、Na+、Ag+、Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com