
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mo/L | D. | 0.4 mo/L |
分析 设生成n(Fe3+)=xmol、n(Fe2+)=ymol,根据转移电子守恒得n(NO)=$\frac{3x+2y}{3}$mol,完全反应后溶液中增加7.0g,则11.2g-$\frac{3x+2y}{3}$mol×30g/mol=7.0g,联立方程组解得x、y值,再根据c=$\frac{n}{v}$计算铁离子浓度.
解答 解:设生成n(Fe3+)=xmol、n(Fe2+)=ymol,根据转移电子守恒得n(NO)=$\frac{3x+2y}{3}$mol,完全反应后溶液中增加7.0g,则11.2g-$\frac{3x+2y}{3}$mol×30g/mol=7.0g,联立方程组得
$\left\{\begin{array}{l}{56(x+y)=11.2}\\{11.2-\frac{3x+2y}{3}×30=7.0}\end{array}\right.$解得$\left\{\begin{array}{l}{x=0.02}\\{y=0.18}\end{array}\right.$,
c(Fe3+)=$\frac{n}{V}=\frac{0.02mol}{0.2L}$=0.1mol•L-1,
故选A.
点评 本题考查氧化还原反应有关计算,侧重考查学生分析计算能力,明确反应过程中存在的原子守恒、转移电子守恒是解本题关键,利用守恒法分析解答,题目难度不大.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知①Fe(s)+$\frac{1}{2}$O2(g)═FeO(s)△H1=-272 kJ/mol;②2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H2=-1675kJ/mol,则2Al(s)+3FeO(s)=Al2O3(s)+3Fe(s);△H=-859 kJ/mol | |
| B. | 25℃时,向10mL物质的量浓度均为0.10mol/LNaOH和NH3•H2O的混合溶液中,逐滴滴加 10mL0.10mol/L 盐酸,混合溶液中 c(NH4+)+c(H+)=c(OH-) | |
| C. | 25℃时,向0.10mol/LNaHSO3溶液中通入NH3至溶液PH=7(体积变化忽略),则有:c(Na+)>c(NH4+)>c(SO32-) | |
| D. | 比较Na2S2O3溶液与不同浓度稀硫酸反应速率的快慢是通过测定出现黄色沉淀的快慢来比较的,而不是采用排水法测量单位时间内气体体积的大小进行比较的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石英坩埚耐高温,可用来加热熔化NaOH固体 | |
| B. | 二氧化硫具有强氧化性,可用于漂白纸张 | |
| C. | 铝能置换出氧化铁中的铁,工业上利用铝热反应冶炼铁 | |
| D. | 医用酒精能使蛋白质变性,可用来消毒杀菌 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学反应速率和限度与生产、生活密切相关.
化学反应速率和限度与生产、生活密切相关.| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL)(标准状况) | 100 | 240 | 464 | 576 | 620 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 中子数为3的He原子:32He | B. | HCl的电子式: | ||
| C. | S2-的结构示意图: | D. | 肼(N2H4)的结构简式:H2N-NH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{92}^{235}U$是核电站的主要原料,2.35g${\;}_{92}^{235}U$的中子数为0.92NA | |
| B. | ${\;}_{53}^{131}I$具有放射性,1.31g${\;}_{53}^{131}I$具有的中子数为0.78NA | |
| C. | 标准状况下,11.2L氦气中约含有NA个氦原子 | |
| D. | 0.1mol•L-1Na2CO3溶液中含有0.1NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 温度(℃) | |||
| 起始物质的量(mol) | 平衡物质的量(mol) | |||
| CH3OH(g) | CH3OCH3(g) | H2O(g) | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 387 | 0.40 | ||
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
| A. | 该反应的逆反应为放热反应 | |
| B. | 达到平衡时,容器Ⅰ中的CH3OH体积分数比容器Ⅱ中的小 | |
| C. | 达到平衡时,容器Ⅰ中的压强与容器Ⅲ中的压强相同 | |
| D. | 若起始时向容器Ⅰ中充入CH3OH 0.15 mol、CH3OCH3 0.15 mol 和H2O 0.10 mol,则反应将向正反应方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
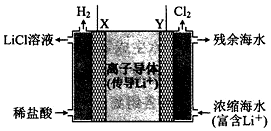 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )| A. | 电池工作时,Li+通过离子电子导体移向b区 | |
| B. | 电流由X极通过外电路移向Y极 | |
| C. | 正极发生的反应为:2H++2e-=H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com