
【题目】(1)根据右图回答①②:
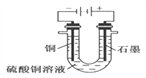
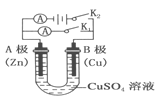
①断开 K2,闭合 K1。B 极的电极反应式为__________。
②断开 K1,闭合 K2。B 极的电极反应式为__________。
(2)根据右图回答③④:
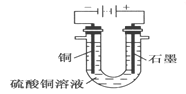
③将较纯净的CuSO4溶液放入如图2 所示的装置中进行电解电解反应的离子方程式为___________________。
④实验完成后,铜电极增重a g,石墨电极产生标准状况下的气体体积________L。
(3)以连二硫酸根(S2O42-)为媒介,使用间接电化学法也可处理燃煤烟气中的 NO),装置如图所示:
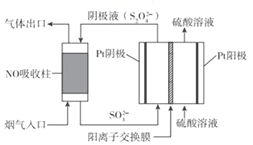
阴极区的电极反应式为_________。
(4)银锌碱性电池的电解质溶液为 KOH 溶液,电池放电时正极的 Ag2O2 (Ag 为+2价) 转化为Ag ,负极的Zn转化为K2Zn(OH)4,写出该电池总反应方程式______。
【答案】 Cu2++2e-=Cu Cu-2e-=Cu2+ 2Cu2++2H2O![]() 2Cu+O2+4H+ 0.175a 2SO32-+2e-+4H+=S2O42-+2H2O 2H2O+Ag2O2+2Zn+4KOH=2Ag+2K2Zn(OH)4
2Cu+O2+4H+ 0.175a 2SO32-+2e-+4H+=S2O42-+2H2O 2H2O+Ag2O2+2Zn+4KOH=2Ag+2K2Zn(OH)4
【解析】
(1)①断开 K2,闭合 K1,此装置为原电池,A做负极失电子,B做正极得电子,所以B 极的电极反应式为Cu2++2e-=Cu。故正确答案为:Cu2++2e-=Cu。
②断开 K1,闭合 K2此装置为电解池,A为电解池阴极得电子,B为电解池阳极失电子。所以B 极的电极反应式为Cu-2e-=Cu2+。故正确答案为:Cu-2e-=Cu2+。
(2)③将较纯净的CuSO4溶液放入如图2 所示的装置中进行电解,阳极水中的氢氧根失电子,溶液中铜离子得电子,电解反应的离子方程式为2Cu2++2H2O![]() 2Cu+O2+4H+ 。故本题正确答案为:2Cu2++2H2O
2Cu+O2+4H+ 。故本题正确答案为:2Cu2++2H2O![]() 2Cu+O2+4H+。
2Cu+O2+4H+。
④实验完成后,铜电极增重a g,![]() ,转移
,转移![]() 电子,由可以知道
电子,由可以知道![]() ═
═![]() ,生成
,生成![]() ,
,
则体积为![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() 。
。
(3)根据装置图在阴极区里入口进入的是2SO32-,出口出来的物质是S2O42-,根据两种离子中S元素的化合价变化关系,该阴极区的电极反应式为:2SO32-+2e-+4H+=S2O42-+2H2O,所以本题的正确答案为:2SO32-+2e-+4H+=S2O42-+2H2O 。
(4).根据题意,首先写出方程式等号左右两边的反应物和生成物,即反应物有Ag2O2和Zn,生成物有2K2Zn(OH)4和Ag,这四种物质是涉及了化合价升降的物质,先把有化学价升降的元素配平,Ag由+2价变成0价,Zn由0价升到+2价,即Ag和Zn的原子个数要相同,因此可先配平Ag2O2、Zn、KOH、K2Zn(OH)4、Ag这5种物质,然后等式左边会少了氢和氧,那么一般电池中如果少了氢和氧就可以用水来配平,因此,在等式左边加上水再配平。故正确答案为:2H2O+Ag2O2+2Zn+4KOH=2Ag+2K2Zn(OH)。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】重铬酸钾是工业生产和实验室的重要氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3,杂质为SiO2、Al2O3)为原料生产它,实数室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下图。
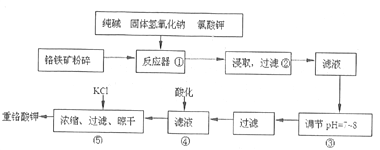
涉及的主要反应是:6FeO·Cr2O3+24NaOH+7KClO3![]() 12Na2CrO4+3Fe2O3+7KC1+12H2O。
12Na2CrO4+3Fe2O3+7KC1+12H2O。
(1)进入反应器①之前将铬铁矿粉碎的目的是____________________________。
(2)步骤②过滤得到的滤渣主要成分是_______________。过滤所需的玻璃仪器有_________________。
(3)操作④中酸化时,CrO42-转化为Cr2O72-,写出平衡转化的离子方程式:_________________________。
(4)操作③调节溶液pH=7~8的目的是_________________________。
(5)工业上也常用电解法处理酸性含铬废水,用耐酸电解槽,铁板作电极,槽中盛放酸性含Cr2O72-的废水,原理示意图如下图。

B为电解池的________极,写出阳极的电极反应式____________________。阳极区域溶液中发生反应的离子方程式为____________________________________。为了使Cr3+和Fe3+转化为Fe(OH)3和Cr(OH)3沉淀,向反应后的溶液中加入一定量的烧碱,若溶液中c(Fe3+)=1.0×10-12mo1·L-1,则溶液中c(Cr3+)=_________mo1·L-1。{已如Ksp[Fe(OH)3]=4.0×10-28,Ksp[Cr(OH)3]=6.0×10-31}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,A是可用来对自来水进行消毒的黄绿色单质气体,A、B、C、D、E都含X元素,其转化关系如图所示。
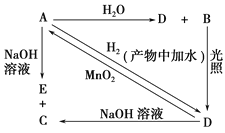
(1)请分别写出A、B、D的化学式(如为溶液请填溶质的化学式):A________、B________、D________;
(2)写出下列反应的化学方程式或离子方程式(请注明条件):
A+H2O(离子方程式):____________________;
A+NaOH(离子方程式):_____________________;
D→A(化学方程式):__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课题组以纳米 Fe2O3 作为电极材料制备锂离子电池(另一极为金属锂和石墨的复合材料),通过在室温条件下对锂离子电池进行循环充放电,成功地实现了对磁性的可逆调控(如图)。以下说法正确的是
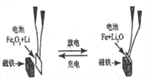
A. 放电时,正极的电极反应式为 Fe2O3+6Li++6e-=2Fe+3Li2O
B. 该电池可以用水溶液做电解质溶液
C. 放电时,Fe 作电池的负极,Fe2O3作电池的正极
D. 充电时,Li+向纳米Fe2O3这极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.控制变量法是化学实验的一种常用方法。下表是某学习小组研究等物质的量浓度的稀硫酸和锌反应的实验数据,分析以下数据,回答下列问题:
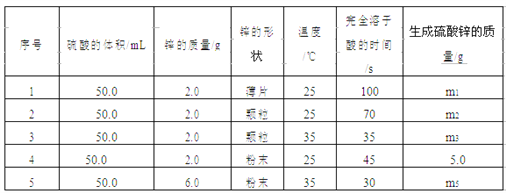
(1)本实验中实验 2 和实验 3 表明________对反应速率有影响。
(2)若采用与实验 1 完全相同的条件,但向反应容器中滴加少量硫酸铜溶液,发现反应速率明显加快。原因是______________________________。
Ⅱ.某温度时,在 5 L 的容器中,X、Y、Z 三种气体的物质的量随时间的变化曲线如图所示。请通过计算回答下列问题:
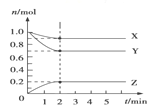
(3)反应开始至 2 min,Y 的平均反应速率_______mol/(L·min)。
(4)反应开始至 2 min,X 的转化率________。
(5)写出 X、Y、Z 的反应方程式________________。
Ⅲ.(6)C2H5OH-O2-KOH 溶液燃料电池,则负极电极反应式为________。反应进行后,溶液的 pH________(填“增大”、“减小”或“不变”)。
(7)将该反应 Fe+2FeCl3=3FeCl2 设计成原电池。则负极材料为_______,正极材料为______。正极反应式________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是

A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】217年5月4日《光明日报》报道称,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了 CO2直接加氢制汽油的过程。其转化过程如图所示。
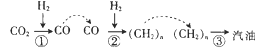
下列说法正确的是
A. 反应①的产物中含有水
B. 反应②为化合反应
C. 所制得汽油的主要成分是烃和烃的含氧衍生物
D. 这种人造汽油用作汽车的燃料时,汽车尾气中不含氮氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 14C常用于测定生物遗骸的年份.下列说法中正确的是( )
A.14C相对原子质量等于14
B.14C与14N中子数一定不同
C.14C与C60互为同素异形体
D.14C与12C是两种不同的元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科研人员设想用如图所示装置生产硫酸,下列说法正确的是( )
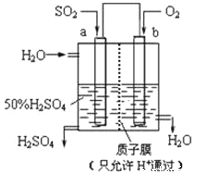
A. a为正极,b为负极
B. 生产过程中a电极质量减轻
C. 电子从b极向a极移动
D. 负极反应式为:SO2+2H2O﹣2e﹣=SO42﹣+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com