
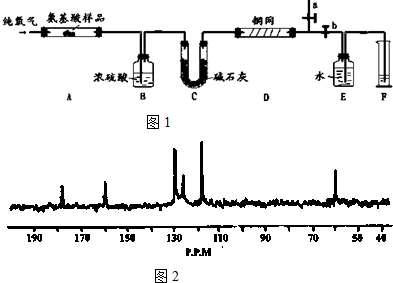
 .
. 分析 该实验原理为:3.34g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.装置B内盛放浓硫酸,吸收生成的水,根据装置B增重,确定3.34g 该种氨基酸中含氢元素质量,根据C中碱石灰的增重可确定C元素的质量,D用于除去氧气,根据F中水的体积确定氮气的体积,并由此确定待测氨基酸中含有的氮元素的质量,在计算氧元素的质量,确定分子中元素原子个数比,由此确定最简式,
(1)利用排水法测定氮气的体积,确定Wg该种氨基酸中含氮元素质量;
(2)加热时应尽量考虑保证最终收集的气体为N2;
(3)由反应原理可知,铜网吸收未反应的O2;
(4)B中浓硫酸增重1.62g,C中碱石灰增重7.04g,F中收集到224mL气体,可分别计算H、C、N的质量,结合总质量确定O的质量,可确定实验式,X的相对分子质量为167,可计算分子式;
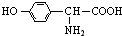
(5)3.34g X的物质的量为$\frac{3.34g}{167g/mol}$=0.02mol,与0.2mol/L 的NaOH溶液反应,最多能中和NaOH溶液200mL,即消耗0.04molNaOH,说明有机物含有1个羧基、1个酚羟基,由核磁共振碳谱可知苯环有两个取代基,且为对位.
解答 解:该实验原理为:3.34g 该种氨基酸放在纯氧中充分燃烧,生成CO2、H2O和N2.装置B内盛放浓硫酸,吸收生成的水,根据装置B增重,确定3.34g 该种氨基酸中含氢元素质量,根据C中碱石灰的增重可确定C元素的质量,D用于除去氧气,根据F中水的体积确定氮气的体积,并由此确定待测氨基酸中含有的氮元素的质量,在计算氧元素的质量,确定分子中元素原子个数比,由此确定最简式,
(1)装置的空气中含有N2,影响生成氮气的体积测定,需将装置中的N2排净,故答案为:将装置中的N2排尽;
(2)应先点燃D处的酒精灯,吸收未反应的氧气,保证最终收集的气体为N2,故答案为:D;
(3)由原理可知,气体进入装置E之前应该先将氧气除去,所以铜网的作用是吸收未反应的氧气,以保证最终收集的气体为N2,
故答案为:吸收未反应的O2,保证最终收集到的气体是反应生成的N2;
(4)实验室用质谱仪测定有机物的相对分子质量,
B中浓硫酸增重1.62g,为水的质量,则可知n(H2O)=$\frac{1.62g}{18g/mol}$=0.09mol,m(H)=0.18g,C中碱石灰增重7.04g,为二氧化碳的质量,n(CO2)=$\frac{7.04g}{44g/mol}$=0.16mol,m(C)=0.16mol×12g/mol=1.92g,F中收集到224mL气体,为氮气,且n(N2)=$\frac{0.224L}{22.4L/mol}$=0.01mol,m(N)=0.01mol×2×14g/mol=0.28g,
所以m(O)=3.34g-0.18g-1.92g-0.28g=0.96g,n(O)=$\frac{0.96g}{16g/mol}$=0.06mol,
则N(C):N(H):N(O):N(N)=0.16:0.18:0.06:0.02=8:9:3:1,实验式为C8H9O3N,相对分子质量为167,则分子式为C8H9O3N,
故答案为:质谱仪;C8H9O3N;
(5)3.34g X的物质的量为$\frac{3.34g}{167g/mol}$=0.02mol,与0.2mol/L 的NaOH溶液反应,最多能中和NaOH溶液200mL,即消耗0.04molNaOH,说明有机物含有1个羧基、1个酚羟基,由核磁共振碳谱可知苯环有两个取代基,且为对位.应为 ,故答案为:
,故答案为: .
.
点评 本题考查测定有机物分子中元素含量的方法,题目难度中等,明确实验原理为解答关键,注意根据原子守恒法进行分析,试题有利于提高学生的分析、理解能力及化学实验能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠与少量硫酸氢钠溶液反应:HCO3-+HSO4-═CO2↑+H2O+SO42- | |
| B. | 硫酸氢钾溶液中滴入氢氧化钡溶液至完全沉淀: Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| C. | Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-═2Fe2++I2 | |
| D. | NH4Al(SO2)2溶液中加入过量Ba(OH)2溶液: Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤的干馏和石油的分馏均属化学变化 | |
| B. | 液化石油气和天然气的主要成分都是甲烷 | |
| C. | 石油裂解、裂化和重整都是有机高分子生成小分子的过程 | |
| D. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:
现有A、B、C、D、E五种元素,原子序数依次增大,且不超过36.A元素的基态原子最外层电子数是次外层的三倍;B元素的基态原子核外有13种不同运动状态的电子;C与B同一周期,原子中未成对电子数是同周期中最多的;D2-的核外电子排布与氩原子相同;E元素的基态原子价电子排布式为3d104s1.请根据相关信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③⑤ | B. | ③④ | C. | ①③ | D. | ①⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③ | C. | ①③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
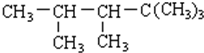
| A. | 2-乙基戊烷 | B. | 2,3-二甲基庚烯 | ||
| C. | 2,3-二甲基-5-庚烯 | D. | 2,2,3,4-四甲基戊烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 复合材料的使用可以使太阳能帆板承受超高温 | |
| B. | 复合材料的使用可以使“神舟”飞船质量变轻 | |
| C. | 复合材料的使用可以使太阳能帆板承受超高强度的改变 | |
| D. | 复合材料的使用可以使太阳能帆板承受温差造成的热胀冷缩的难题 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com