
| A. | 质量 | B. | 密度 | C. | 碳原子数 | D. | 原子总数 |
分析 根据阿伏伽德罗定律:同温同压下,容积相等的任何气体具有相同的分子数结合C2H4、C2H2、C2H6每个分子中的C原子数的个数特点来回答.
解答 解:同温同压下,两个储气瓶的容积又相等,所以两瓶中气体的物质的量就相等,即两瓶内气体的分子数相同,
C2H4、C2H2、C2H6每个分子中的C原子数都是2,所以碳原子数相同,
根据m=nM,两瓶中装有C2H2和C2H6的混合气体的瓶子M无法确定,所以m无法判断,
据ρ=$\frac{m}{V}$,V一定,m无法判断,所以ρ无法判断,C2H2和C2H6的量不确定,所以原子数也无法确定.
故选C.
点评 本题考查阿伏伽德罗定律及推论,题目难度不大,有利于基础知识的巩固,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:解答题
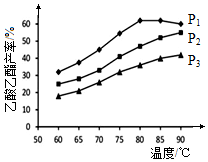 醋酸由于成本较低,在生产中被广泛应用.
醋酸由于成本较低,在生产中被广泛应用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MgO固体(Al2O3) | B. | Na2CO3溶液(NaHCO3) | ||
| C. | MgCl2溶液(AlCl3) | D. | 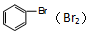 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
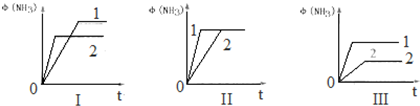
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
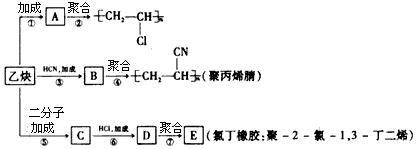
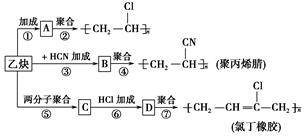
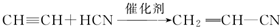 ;加成反应
;加成反应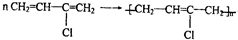 ;加聚反应
;加聚反应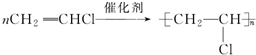 ,写出聚氯乙烯的链节
,写出聚氯乙烯的链节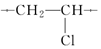 ,单体的结构简式CHCl═CH2;
,单体的结构简式CHCl═CH2; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
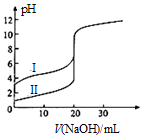 25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | V(NaOH)=20.00mL时,两溶液中 c(CH3COO-)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | 该反应1molCl2得到2mole- | ||
| C. | 反应中Cl2既是氧化剂,又是还原剂 | D. | NaClO2和ClO2中Cl的化合价相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com