
| A.向醋酸钠溶液中加水稀释时,溶液中所有离子浓度都减小 |
| B.电解精炼铜时,阳极泥中含有Zn、Fe、Ag、Au等金属 |
| C.8NH3(g)+6NO2(g)=7N2(g)+12H2O(g) △H<0,则该反应一定能自发进行 |
D.对N2(g)+3H2(g) 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 2NH3(g),其他条件不变时充入N2,正反应速率增大,逆反应速率减小 |
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的ΔH<0 |
| B.镀锌铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锡铁则相反 |
C.对于N2(g)+3H2(g) 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 2NH3(g),当其他条件不变时,压缩气体体积使压强增大,正反应和逆反应速率以及H2的平衡转化率均增大 |
| D.100℃时水的离子积常数Kw为5.5×10-13,说明水的电离是放热反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Si(s)+3HCl(g)。
Si(s)+3HCl(g)。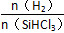 时,反应物X的平衡转化率关系如图所示。
时,反应物X的平衡转化率关系如图所示。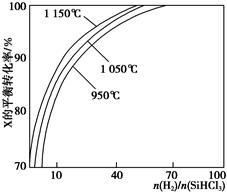
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
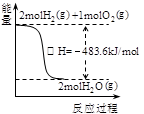
| A.甲表示H2与O2发生反应过程中的能量变化,则H2的烧热为483.6kJ·mol-1 |
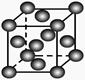
| B.乙表示Cu形成金属晶体时的堆积方式 |
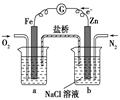
| C.丙装置中烧杯a中的溶液pH降低 |
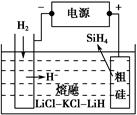
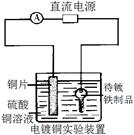
| D.丁装置中待镀铁制品应与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.反应CO2(g)+C(s)=2CO(g)在高温下可自发进行,则该反应的△H> 0 |
| B.工业上电解饱和食盐水时,以石墨作阴极,铁棒作阳极 |
| C.常温下,0.1mol·L-1 CH3COOH溶液pH=1 |
| D.常温下,在AgCl悬浊液中加入少量NaCl饱和溶液,c(Ag+)减小,Ksp(AgCl) 减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
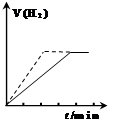



| A.向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,图1虚线表示加入CuSO4溶液时氢气体积与时间的关系 |
| B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- |
| C.向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图3中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图 |
| D.由图4可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡是放热反应都是自发的 |
| B.难溶电解质的溶解平衡是一种动态平衡 |
| C.利用沉淀反应除杂时,可使杂质离子完全沉淀 |
| D.pH=5的盐酸稀释1000倍后,溶液的pH增到8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com