
����Ŀ�������������ͼ��ʾ��ʵ��װ����̽������ˮ��Ӧ(����̨����������)��ʵ��ǰ�������¶˴�һ��С��Ѩ����һ��С���е��ƿ�̶�����ͷ�¶ˣ����ϳ鶯��ͷʹ�ƿ���ڿ�Ѩ�ڡ��ڲ�����Ӧ����װ������ˮ(ʹ�ƿ鲻��ˮ�Ӵ�)��ʵ��ʱ����ȥ����ͷ����ס����������ͷ�������ϰ���ʹ����ˮ�Ӵ�����Ӧ���ڵ�Һ�屻����������ѹ�������������·����ձ��У��������ռ��ڷ�Ӧ���ڡ�
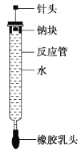
(1)����ˮ��Ӧ�����ӷ���ʽΪ__________________________________________________��
(2)ʵ���С��ƿ��ۻ�Ϊ������С��˵��_____________________�����ձ��е���Һ�еμ�____________����Һ��죬˵������ˮ��Ӧ���ɼ������ʡ�
(3)���ʵ��ǰ���뷴Ӧ����ˮ�����Ϊa mL����ʹˮ����ȫ�����ų�������ȡ�����Ƶ���������Ϊ____________g(�赱ʱʵ������������Ħ�����ΪV mL/mol)��
���𰸡� 2Na+2H2O===2Na++2OH+H2�� ����ˮ�ķ�Ӧ�������������ų���Na�۵�ϵ� ��̪��Һ ![]()
��������
���⣨1������ˮ��Ӧ�����������ƺ���������Ӧ�Ļ�ѧ����ʽΪ��2Na+2H2O=2Na++2OH-+H2������2���ƿ��ۻ�Ϊ������С��˵���Ƶ��۵�ͣ���Ӧ���ȣ�����ˮ��Ӧ�����������ƣ���Һ�ʼ��ԣ��μӷ�̪��Һ��죻��3��ʵ��ǰ���뷴Ӧ����ˮ�����Ϊa mL����ʹˮ����ȫ�����ų��������������Ϊa mL�������ʵ���ΪamL��Vml/mol=a/Vmol��
��2Na+2H2O=2NaOH+H2��
2 1
n(Na) a/Vmol
n(Na)= a/Vmol��2=2a/Vmol��
����Ϊm(Na)=2a/Vmol��23g/mol=46a/Vg��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼ�У�������Ϊij��Һ�м���ij���ʵ����ʵ�����������Ϊ���ɳ��������ʵ�������ͼ�е���ĸ���������±���

��Һ | ��������� | ��ĸ���� |
�ٱ���ʯ��ˮ | ͨ����CO2 | ________ |
��AlCl3��Һ | ͨ����NH3 | ________ |
��MgCl2��AlCl3�����Һ | ��μ�NaOH��Һ������ | ________ |
��AlCl3��Һ | ��μ�NaOH��Һ������ | ________ |
�ݺ�����HCl��AlCl3��Һ | ��μ�NaOH��Һ������ | ________ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��������A�еķ�Ӧ��ʼ�����ֱ�������в�������ش��й����⣺
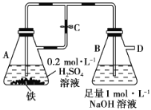
(1)��ֹˮ��C��B��������ʲô��������__________________________________________��
(2)����ʼʱֹˮ��C�رգ�����A�еķ�Ӧ���ڽ���ʱ��B��������ʲô��������_________________��д��B�������йط�Ӧ�Ļ�ѧ����ʽ��_____________________��
(3)���ȴ�ֹˮ��Cһ��ʱ�䣬����A�еķ�Ӧ���ڽ���ʱ���ٹر�ֹˮ��Cһ�����B��������ʲô��������_________________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ϵͳ�����У���ȷ����( )
A. ![]() 2��4����������
2��4����������
B. ![]() 2������4����Ȳ
2������4����Ȳ
C. ![]() 2,3-����-2,4-���ϩ
2,3-����-2,4-���ϩ
D. 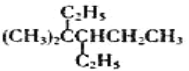 4��4��������3���һ�����
4��4��������3���һ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijϩ����H2�����ӳɷ�Ӧ��õ��IJ�����CH3CH��CH3��2��
��1���ò����ϵͳ����������Ϊ______��д���ò����ͬ���칹��Ľṹ��ʽ______
��2�����������£��ò�����������Ӧ�����ɺ���������һ�ȴ��д����Ӧ�Ļ�ѧ����ʽ______________________ ����Ӧ������______________
��3��ԭ��ϩ���Ľṹ��ʽΪ��______��ϵͳ����������Ϊ______________
��4��д����ϩ��һ�������·����Ӿ۷�Ӧ�ķ���ʽ��_____________��
��5��д��ԭ����ϩ��ʹ������Ȼ�̼��Һ��ɫ�Ļ�ѧ��Ӧ����ʽ��____�� ��Ӧ������__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����500 mL NaOH��Һ��Ͷ��10.8 g Al������ǡ����ȫ��Ӧ������㣺
��1��Al�����ʵ�����
��2���μӷ�Ӧ��NaOH�����ʵ�����ԭ��Һ�����ʵ����ʵ���Ũ�ȡ�
��3���ڱ�״��������H2�������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ����Ͱ�ˮ����ѧ��ѧ�г���������������ijУʵ��С������Ũ���ᡢ�������Ũ��ˮ�ֱ�������Ũ�Ⱦ�Ϊ0.1 mol��L��1��������Һ��100 mL���������ʵ�飬�ݴ˻ش��������⣺
��1������������������Һ��PH�ɴ�С��˳����____________________��
��2��25��ʱ������pH��ֽ���0.1 mol��L��1������Һ��pHԼΪ5������Թ��������ĵ��볣��ԼΪ__________________����10 mL����Һ�м��������������������ܽ��������Һ�¶Ⱥ������С�仯����Һ��![]() ��ֵ��_________(��������������С������ȷ����)��
��ֵ��_________(��������������С������ȷ����)��
��3����Ũ�Ⱦ�Ϊ0.1 mol��L��1������Ͱ�ˮ�����������������û����Һ��_______��(����������������������������)��ԭ����__________________(�����ӷ���ʽ��ʾ)��
�����û����Һ���������ӵ����ʵ���Ũ���ɴ�С��˳��Ϊ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڿ��淴Ӧ4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)��������������ȷ����
4NO(g)+6H2O(g)��������������ȷ����
A���ﵽ��ѧƽ��״̬ʱ��4v��(O2)= 5v��(NO)
B������λʱ��������x mol NO��ͬʱ������x mol NH3����Ӧ�ﵽ��ѧƽ��״̬
C���ﵽ��ѧƽ��״̬�������������ݻ���������Ӧ���ʼ�С���淴Ӧ��������
D����ѧ��Ӧ���ʵĹ�ϵΪ2v��(NH3)= 3v��(H2O)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�����Ӧ�õ�˵���У�����ȷ���ǣ� ��
A.Na2CO3�Ƿ��ͷ۵���Ҫ�ɷ�֮һB.MgO���������²���
C.�⻯���������˹�����D.��������������ˮ����
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com