
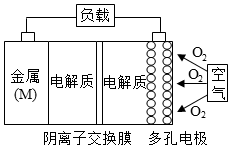
 已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )
已知:电池的理论比能量指单位质量的电极材料理论上能释放出的最大电能.镁一空气电池的总反应方程式为:2Mg+O2+2H2O=2Mg(OH)2,其工作原理如图所示,下列说法不正确是( )| A. | 该电池的放电过程的正极反应为O2+4e-+2H2O=4OH- | |
| B. | 为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜 | |
| C. | 采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极 | |
| D. | 与铝一空气电池相比,镁一空气电池的比能量更高 |
分析 A.正极上氧气得电子和水反应生成OH-;
B.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-;
C.反应物接触面积越大,反应速率越快;
D.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多;
解答 解:A.正极上氧气得电子和水反应生成OH-,因为是阴离子交换膜,所以阳离子不能进入正极区域,则正极反应式为O2+2H2O+4e-=4OH-,故A正确;
B.负极上Mg失电子生成Mg2+,为防止负极区沉积Mg(OH)2,则阴极区溶液不能含有大量OH-,所以宜采用中性电解质及阳离子交换膜,故B正确;
C.反应物接触面积越大,反应速率越快,所以采用多孔电极的目的是提高电极与电解质溶液的接触面积,并有利于氧气扩散至电极表面,从而提高反应速率,故C正确;
D.电池的“理论比能量”指单位质量的电极材料理论上能释放出的最大电能,则单位质量的电极材料失去电子的物质的量越多则得到的电能越多,假设质量都是1g时,这镁、铝两种金属转移电子物质的量分别为$\frac{1}{24}$×2=$\frac{1}{12}$mol、$\frac{1}{27}$×3=$\frac{1}{9}$mol,所以Al-空气电池的理论比能量最高,故D错误;
故选D.
点评 本题考查原电池原理,为高频考点,侧重考查学生分析判断、获取信息解答问题及计算能力,明确各个电极上发生的反应、离子交换膜作用、反应速率影响因素、氧化还原反应计算是解本题关键.


科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl 质子数相同 | |
| B. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl互为同素异形体 | |
| C. | ${\;}_{81}^{203}$Tl 和 ${\;}_{81}^{205}$Tl中子数之差为2 | |
| D. | ${\;}_{81}^{205}$Tl 原子核内中子数与核外电子数之差为43 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铜和醋酸反应:Cu+2CH3COOH═2CH3COO-+Cu2++H2↑ | |
| B. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 锌与硝酸银溶液反应:Zn+Ag+═Zn2++Ag | |
| D. | 稀硝酸和石灰乳反应:H++OH-═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧根离子的电子式是  | |
| B. | 二氧化碳分子的比例模型是 | |
| C. | 次氯酸的结构简式为H-Cl-O | |
| D. | 12C和14C的原子结构示意图均可表示为  |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH2CH2CH3和CH3CH(CH3)2 | B. | CH2=C(CH3)2和CH2=CHCH=CH2 | ||
| C. | O2和O3 | D. | CH3CH2OH和CH3-O-CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是分解反应 | B. | 反应中氮元素的化合价降低 | ||
| C. | 氧化剂是N2O4 | D. | 该反应不是氧化还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③均是氧化还原反应 | |
| B. | 反应②中氧化剂与还原剂的物质的量之比为1:6 | |
| C. | 氧化性强弱顺序是:K2Cr2O7>I2>Fe2(SO4)3 | |
| D. | 反应③中0.1mol还原剂共失去电子数为0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com