
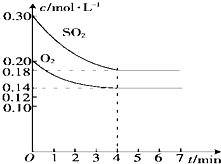
 在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2+O2?2SO3(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示.请回答下列问题:
在容积为10L的密闭容器中通入一定量的SO2和O2,450℃时发生反应:2SO2+O2?2SO3(正反应放热),SO2和O2的物质的量浓度随反应时间的变化如图所示.请回答下列问题:| 改变的条件 | v正 | v逆 |
| ①减小SO2的浓度 | 减小 | 不变 |
| ②减小SO3的浓度 | 不变 | 减小 |
| ③缩小容器的体积 | 增大 | 增大 |
| ④加入V2O5作催化剂 | 增大 | 增大 |
分析 (1)△c(SO2)=0.30mol/L-0.18mol/L=0.12mol/L,据v=$\frac{△c}{△t}$代入数据计算;
(2)影响反应速率的外界因素有温度、浓度、压强和催化剂,注意瞬时速率.
解答 解:(1)v=$\frac{△c}{△t}$=$\frac{0.12mol/L}{4min}$=0.03mol/(L•min),故答案为:0.03;
(2)①减小SO2的浓度,正反应速率减慢,故答案为:减小;
②减小SO3的浓度,改变条件的瞬间正反应速率不变,然后减慢,故答案为:不变;
③缩小容器的体积,反应物浓度增大,正反应速率加快,故答案为:增大;
④加入V2O5作催化剂,正逆反应速率增大,故答案为:增大.
点评 本题考查了化学反应速率的求算和影响化学反应速率的因素,注意瞬间变化,题目难度不大.


 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
| A. | ② | B. | ②⑤ | C. | ①③⑤ | D. | ③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
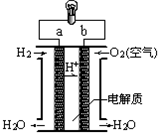
| A. | a极是负极 | |
| B. | 电流由b通过灯泡流向a | |
| C. | 正极的电极反应是:O2+2H2O+4e-═4OH- | |
| D. | 氢氧燃料电池是环保电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾的密度比钠的小 | B. | 加热时,钾比钠更易气化 | ||
| C. | 钾与水反应比钠与水反应更剧烈 | D. | 钾原子的电子层比钠原子多一层 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 57.3 kJ•mol-1 | B. | 114.9 kJ•mol-1 | C. | 171.9 kJ•mol-1 | D. | 229.2 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.
某化学兴趣小组为探究元索性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原电池的负极、电解池的阳极均发生氧化反应 | |
| B. | 原电池将化学能转化为电能,电解池将电能转化为化学能 | |
| C. | 电解水制取H2和O2时,为了增强导电性,可加入NaOH、NaCl、H2SO4 | |
| D. | 利用原电池原理可制备化学电源,利用电解池原理可制备化学物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用红外光谱可鉴别乙醇和二甲醚,用X-射线衍射实验可鉴别玻璃与水晶 | |
| B. | 煤的主要成分是单质碳、苯、二甲苯等,可通过煤的干馏将它们分离 | |
| C. | 聚氯乙烯塑料可制作保鲜膜、一次性食品袋 | |
| D. | 聚乙烯塑料的老化是由于发生了加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
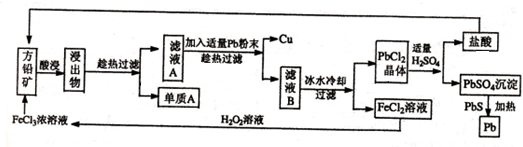
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com