
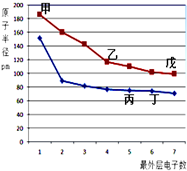
 如图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )
如图是短周期元素原子半径与最外层电子数的关系图,其中乙单质是半导体,下列说法正确的是( )| A、丙的氢化物与丙的最高价氧化物的水化物不能发生化合反应 |
| B、气态氢化物的稳定性:丙>丁>戊 |
| C、甲的离子半径比丁的简单离子半径小 |
| D、乙与丁形成的化合物含共价键,同时是两性氧化物 |


科目:高中化学 来源: 题型:
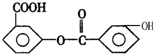 ,关于它的性质叙述中不正确的是( )
,关于它的性质叙述中不正确的是( )| A、有机物可与NaHCO3溶液反应,1mol该有机物最多可与4mol NaOH反应 |
| B、有机物的分子式为C14H10O5 |
| C、在催化剂条件下,1mol该有机物与H2反应,最多消耗H2的物质的量为8mol |
| D、酸性条件下可发生水解反应,且产物只有一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与AlCl3溶液发生反应的离子方程式为Al3++3OH-═Al(OH)3↓ |
| B、其溶液的pH=13 |
| C、用适量水稀释后,NH3?H2O电离度和溶液pH都增大 |
| D、加水稀释后,溶液中c(NH4+)?c(OH-)变小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| B、氯水和活性炭使红墨水褪色 |
| C、漂白粉和水玻璃长期暴露在空气中变质 |
| D、二氧化碳和二氧化硫都能使澄清石灰水变浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片和镁片用导线连接后插入NaOH溶液中,镁片较活泼,作负极 |
| B、铝片和铜片用导线连接后插入浓硝酸中,铜作负极 |
| C、镀锌铁和镀锡铁的镀层破损后,前者较易被腐蚀 |
| D、将反应2Fe3++Fe═3Fe2+设计为原电池,则可用锌片作负极,铁片作正极,FeCl3溶液作电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、天然气燃烧提供热量 |
| B、氯水使红色纸张褪色 |
| C、钢铁制品在空气中被腐蚀 |
| D、二氧化硫通人品红溶液中,溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com