
已知:25℃时,Ka(HAc)=1.7×10-5 mol /L。现有如下溶液:
①0.1mol/LHAc与0.1mol/LNaOH溶液等体积混合液
②pH = 3的HAc与pH = 11的NaOH溶液等体积混合液
③0.1 mol /LH2SO4与0.2mol/LNaOH溶液等体积混合液
常温时,三者pH大小关系正确的是
| A.①>③>② | B.③>①>② | C.①>②>③ | D.②>③>① |
A
解析试题分析:NaOH是强碱,HAc是弱酸。①0.1mol/LHAc与0.1mol/LNaOH溶液等体积混合液时恰好完全发生反应得到NaAc。由于NaAc是强碱弱酸盐。在溶液中Ac-发生水解反应。Ac-+H2O HAc+ OH-。所以溶液显碱性。②pH = 3的HAc溶液c(H+)=10-3mol/L,由于HAc是弱酸,部分电离,所以c(HAc) >10-3mol/L pH = 11的NaOH溶液,c(OH-)=10-3mol/L。若二者等体积混合液则溶液为NaAc和HAc的混合溶液。由于HAc的电离作用大于Ac-水解作用,所以溶液显酸性。③0.1 mol /LH2SO4与0.2mol/LNaOH.因为H2SO4是二元强酸,NaOH是一元强碱,所以量溶液中的c(OH-)= c(H+)若等体积混合液,则n(OH-)=n(H+).因此溶液显中性。常温时,三者pH大小关系正确的是①>③>②。选项为A。
HAc+ OH-。所以溶液显碱性。②pH = 3的HAc溶液c(H+)=10-3mol/L,由于HAc是弱酸,部分电离,所以c(HAc) >10-3mol/L pH = 11的NaOH溶液,c(OH-)=10-3mol/L。若二者等体积混合液则溶液为NaAc和HAc的混合溶液。由于HAc的电离作用大于Ac-水解作用,所以溶液显酸性。③0.1 mol /LH2SO4与0.2mol/LNaOH.因为H2SO4是二元强酸,NaOH是一元强碱,所以量溶液中的c(OH-)= c(H+)若等体积混合液,则n(OH-)=n(H+).因此溶液显中性。常温时,三者pH大小关系正确的是①>③>②。选项为A。
考点:考查等体积酸、碱溶液混合时的pH大小关系的知识。


科目:高中化学 来源: 题型:单选题
H2C2O4水溶液中H2C2O4、HC2O4-和C2O42-三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示[已知Ksp(CaC2O4)=2.3×10-9]。下列说法正确的是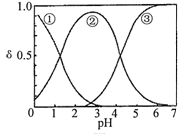
| A.曲线①代表的粒子是HC2O4- |
| B.0.1 mol·L-1 NaHC2O4溶液中:c(C2O42-)>c(H2C2O4) |
| C.pH=5时,溶液中主要含碳物种浓度大小关系为:c(C2O42-)>c(H2C2O4)>c(HC2O4-) |
| D.一定温度下,往CaC2O4饱和溶液中加入少量CaCl2固体,c(C2O42-)将减小,c(Ca2+)不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
锅炉水垢是一种安全隐患,除去水垢中的CaSO4,可先用Na2CO3溶液处理,使之转化为易溶于酸的CaCO3,而后用酸除去。下列说法不正确的是:
| A.CaCO3的溶解度小于CaSO4 |
| B.沉淀转化的实质是沉淀溶解平衡的移动 |
| C.沉淀转化的难易与溶解度差别的大小无关 |
| D.CaSO4到CaCO3的沉淀转化中并存着两个沉淀溶解平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知25 ℃时有关弱酸的电离平衡常数:
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡 常数(25 ℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7 K2=5.6×l0-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下表中的实验操作能达到实验目的或能得出相应结论的是
| 选项 | 实验操作 | 实验目的或结论 |
| A | 向盛有1mL 0.01mol·L-1AgNO3溶液的试管中滴加5滴0.01mol·L-1NaCl溶液,有白色沉淀生成,再向其中滴加 0.01mol·L-1NaI溶液,产生黄色沉淀。 | 常温下, Ksp(AgCl)>Ksp(AgI) |
| B | 取少量 KClO3晶体溶于适量的蒸馏水,再加入硝酸酸化的AgNO3溶液。 | 检验KClO3中的氯元素 |
| C | 向某溶液中滴加Ba(NO3)2溶液产生白色沉淀,再加稀盐酸沉淀消失。 | 说明原溶液中一定含有CO32-或 SO32- |
| D | 将混有Ca(OH)2杂质的Mg(OH)2样品,放入水中搅拌成浆状后,加入足量饱和氯化镁溶液充分搅拌、过滤,沉淀用蒸馏水洗涤。 | 除去Mg(OH)2样品中的Ca(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
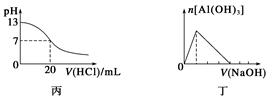
下列关于甲、乙、丙、丁四个图像的说法中,正确的是( )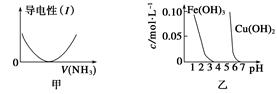
| A.图甲表示向乙酸溶液中通入NH3过程中溶液导电性的变化 |
| B.由图乙可知,若除去CuSO4溶液中的Fe3+可采用向溶液中加入适量CuO至pH在4左右 |
| C.图丙表示25 ℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1氨水,溶液的pH随加入盐酸体积的变化 |
| D.图丁表示向Al2(SO4)3溶液中滴入NaOH溶液,生成Al(OH)3沉淀的量随NaOH溶液体积的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
A.常温下0.4 mol·L-1 HB溶液和0.2 mol·L-1 NaOH溶液等体积混合后溶液的pH=3,则混合溶液中离子浓度的大小顺序为c(Na+)>c(B-)>c(H+)>c(OH-)
B.常温时,pH=2的CH3COOH溶液和HCl溶液、pH=12的氨水和NaOH溶液,四种溶液中由水电离的c(H+)相等
C.常温下0.1 mol·L-1的下列溶液①NH4Al(SO4)2,②NH4Cl,③NH3·H2O,④CH3COONH4中,c(NH4+)由大到小的顺序是:②>①>④>③
D.0.1 mol·L-1 pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-)
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
常温下,将a L 0.1 mol·L-1的NaOH溶液与b L 0.1 mol·L-1的CH3COOH溶液混合,下列有关混合溶液的说法一定不正确的是( )
| A.a<b时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
| B.a>b时,c(CH3COO-)>c(Na+)>c(OH-)>c(H+) |
| C.a=b时,c(CH3COOH)+c(H+)=c(OH-) |
| D.无论a、b有何关系,均有c(H+)+c(Na+)=c(CH3COO-)+c(OH-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com