
| A、用量筒取5.00mL 1.00mol/L盐酸于50mL容量瓶中,加水稀释至刻度,可配制0.100mol/L盐酸 |
| B、将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液 |
| C、用10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
| D、质量分数为10%的氨水与质量分数为20%的氨水等体积混合,所得氨水的质量分数小于15% |
| 10ml×ρ1×98% |
| 100ml×ρ2 |
| 10ml×ρ1×98% |
| 100ρ1 |
| 10%+20% |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准标况下,22.4L水所含的分子数目为6.02×1023个 |
| B、2g氢气所含氢原子数目为2×6.02×1023个 |
| C、500ml2mol?L-1的Ba(NO3)2溶液中含NO3-离子数为2×6.02×1023个 |
| D、0.5mol氯气分子中含Cl原子数为6.02×1023个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 实验室中制取少量蒸馏水 |
B、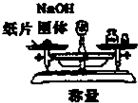 城区一定质量的NaOH固体 |
C、 用滴瓶长期保存NaOH溶液 |
D、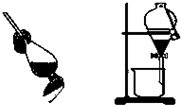 除去乙醇中溶有的少量水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、浓硫酸稀释后马上转移至容量瓶 |
| B、溶解搅拌时有液体飞溅 |
| C、定容时仰视容量瓶瓶颈刻度线 |
| D、摇匀后见液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:
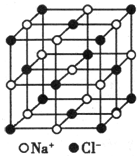 纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )
纳米材料的表面粒子数占总粒子数的比例极大,这是它具有许多特殊性质的原因.假设某氯化钠纳米颗粒的大小和形状恰好与氯化钠晶胞的大小和形状(如图所示)相同.则这种纳米颗粒的表面粒子数占总粒子数的百分数为( )| A、87.5% | B、92.9% |
| C、96.3% | D、100% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、K+、Na+、NO3-、MnO4- |
| B、K+、Na十、Br-、CO32- |
| C、Mg2+、Na+、Cl-、SO42- |
| D、Na十、Ba2+、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、大量进口石油,减少煤炭使用量 |
| B、回收废弃饮料包装纸,制作成公园内的休闲长椅 |
| C、在西部和沿海地区兴建风力发电站,解决能源问题 |
| D、鼓励购买小排量汽车,推广与发展电动、混合动力汽车 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com