
 (10分)某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图。
(10分)某兴趣小组进行“活泼金属与酸反应”的实验,将5.4g的铝片投入500 mL 0.5 mol·L-1的硫酸溶液中,下图为反应产生氢气速率与反应时间的关系图。
(1)关于图像的描述不正确的是 (填序号,下同);
① a → b段产生H2加快可能是表面的氧化膜逐渐溶解,加快了反应速率
② b → c段产生H2较快可能是该反应放热,导致温度升高,加快了反应
③ c以后,产生H2速率逐渐下降可能是铝片趋于消耗完全
(2)其他条件不变,现换用500 mL 1 mol·L-1盐酸,产生氢气速率普遍较使用500 mL
0.5 mol·L-1硫酸的快,可能的原因是________;
①盐酸中c(H+)的浓度更大 ②Cl-有催化作用 ③SO42-有催化作用 ④SO42-有阻化作用(使反应变慢) ⑤Al3+有催化作用
(3)要加快铝与硫酸溶液制H2的反应速率,小组成员提出一系列方案,比如:
①加入某种催化剂; ②加入蒸馏水; ③将铝片换成铝粉;
④增加硫酸的浓度至18 mol/L; ⑤ ; ⑥ _。
以上方案不合理的有 ;请你再补充两种合理方案,填入空白⑤⑥处。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:阅读理解
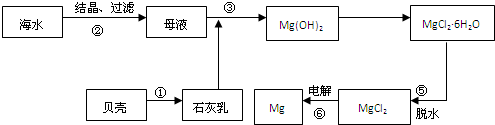
 镁将成为21世纪重要的轻型环保材料.
镁将成为21世纪重要的轻型环保材料.| 熟石灰 |
| 过滤 |
| 盐酸 |
| 蒸发、浓缩、结晶 |
| 脱水 |
| 通电 |
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 所加氢氧化钠溶液的次数 | 第一次 | 第二次 | 第三次 |
| 剩余固体的质量/g | 10.6 | 5.2 | 4.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的BaCl2溶液 | 出现白色沉淀 | |
| ②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验方案 | 实现现象 | 结论 |
| 1取一定量的合金粉末,加过量的 |
粉末部分溶解,并有气体放出. | 合金中一定含有 |
| ②取步骤①所得滤渣,加过量的 |
滤渣部分溶解,并有气体放出,溶液呈浅绿色. | 合金中一定含有 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com