
| A. | (b-a-c)kJ | B. | (3a-b+c )kJ | C. | (a-3b+c)kJ | D. | (b-3a-c)kJ |
分析 已知:①H2O(g)═H2O(l)△H1═-akJ•mol-1
②C2H 5OH(g)═C2H 5OH(l)△H2═-b kJ•mol-1
③C2 H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3═-ckJ•mol-1
由盖斯定律③-②+①×3得:C2 H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-(c-b+3a)kJ•mol-1,再根据反应热计算放出的热量.
解答 解:已知:①H2O(g)═H2O(l)△H1═-akJ•mol-1
②C2H 5OH(g)═C2H 5OH(l)△H2═-b kJ•mol-1
③C2 H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H3═-ckJ•mol-1
由盖斯定律③-②+①×3得:C2 H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=-(c-b+3a)kJ•mol-1,
46g液态酒精的物质的量为$\frac{46g}{46g/mol}$=1mol,所以完全燃烧恢复到室温,放出的热量为1mol×[-(c-b+3a)kJ•mol-1],所以放出热量为:(3a-b+c )kJ,
故选:B.
点评 考查根据盖斯定律计算反应热,难度中等,关键是构造目标热化学反应方程式,注意反应热的符号.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
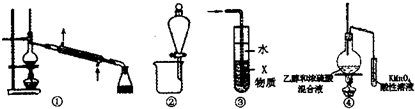
| A. | 装置①可用于石油的分馏 | |
| B. | 装置②可用于苯提取溴水中的Br2 | |
| C. | 装置③中X若为四氯化碳,可用于吸收氨气或氯化氣,并防止倒吸 | |
| D. | 装置④验证乙烯的生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操 作 | 现象 | 结论 |
| A | 实验1:4mL 0.01mol/L KMnO4酸性溶液+2mL 0.1mol/LH2C2O4溶液+4mL水; 实验2:4mL 0.01mol/L KMnO4酸性溶液+4mL 0.1mol/L H2C2O4溶液+2mL水; 记录褪色时间. | 实验2先褪色 | H2C2O4浓度越大反应速率越快. |
| B | 用洁净铂丝蘸取无色溶液进行焰色反应 | 火焰呈黄色 | 无色溶液为钠盐溶液 |
| C | 向砖红色Ag2CrO4沉淀上滴加 0.1mol/LNaCl溶液 | 沉淀变为黑色 | Ksp(Ag2CrO4)>Ksp(AgCl) |
| D | 常温下将Al片放入浓硝酸中 | 无明显变化 | Al与浓硝酸未发生反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuCl2[CuSO4] | B. | NaCl[HCl] | C. | NaOH[Na2O] | D. | CuSO4[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
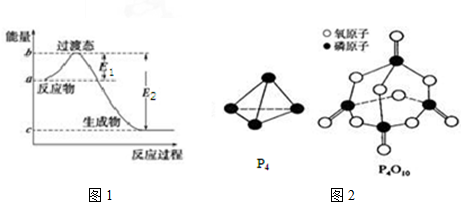
| 化学键 | P-P | P-O | O═O | P═O |
| 键能/kJ•mol-1 | a | b | c | x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最高价氧化物的水化物显酸性 | B. | 非金属性比溴强 | ||
| C. | 原子序数为24 | D. | 氢化物比H2S稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A(s)的质量 | B. | 混合气体的密度 | ||
| C. | 混合气体的压强 | D. | 混合气的平均相对分子质量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com