
| 1.2mol/L |
| 2min |
| V(A) |
| V(C) |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
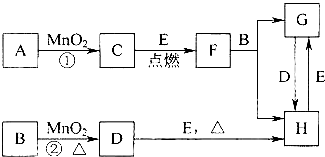
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 �о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮
�о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ�������Ҫ���壮| ���� |
| �� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����ȡ����������ͨ©������� |
| B��Ũ�ռ�Һմ��Ƥ����Ӧ������ϡ�����ϴ |
| C��������ƿ���ƺ�һ��Ũ�ȵ�ij��Һ����Һ����������ƿ�в����ϱ�ǩ |
| D����δ֪Һ����������ζʱ��Ӧ�ý��Լ�ƿ�ھ���ڱ�ԶһЩ���������ᓁ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��0.1mol/LNaF��Һ�У�c��Na+����c��F-����c��H+����c��OH-�� |
| B��Na2SiO3��Һ��ˮϡ�ͺָ���ԭ�¶ȣ�pH��KW����С |
| C��pH=5��HF��Һ��pH=5��NH4NO3��Һ�У�c��H+������� |
| D����Na2S��Һ�м���AgCl���壬��Һ��c��S2-���½� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com