
分析 干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上,据此答题;由CO2晶体模型分析得出,符合题意的最小正方形即模型的对角面的一半.
解答 干冰是分子晶体,CO2分子位于立方体的顶点和面心上,以顶点上的CO2分子为例,与它距离最近的CO2分子分布在与该顶点相连的12个面的面心上;由CO2晶体模型分析得出,符合题意的最小正方形即模型的对角面的一半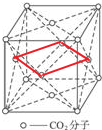 ,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分子,
,则使正方形的四个顶点部落到CO2分子的中心,在这个正方形的平面上有出有4个CO2分子,
故答案为:12;4.
点评 本题考查了晶胞的结构,侧重于考查晶胞结构的分析和计算,注意利用均摊法计算晶胞中各种原子个数,题目难度中等,解题关键是仔细观察晶胞结构图.


 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:解答题
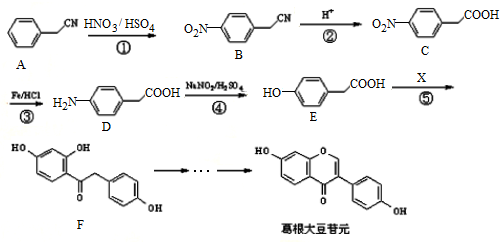

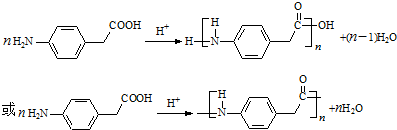 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠 | B. | 铜 | C. | 铝 | D. | 汞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
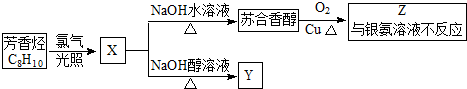
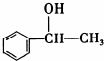 ,它不能发生的有机反应类型有④、⑥.
,它不能发生的有机反应类型有④、⑥.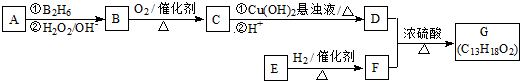
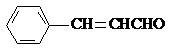 .
.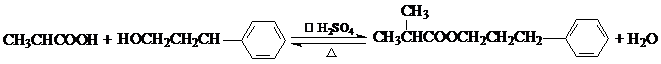 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:
已知1mol SO2(g)氧化为1mol SO3的△H=-99kJ•mol-1.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH3是非极性分子 | B. | PH3分子中的P-H 键是非极性键 | ||
| C. | PH3中心原子杂化轨道类型为sp2型 | D. | PH3分子中有未成键的电子对 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机化合物中,σ键比π键重叠程度大,形成的共价键强 | |
| B. | N2H4分子中有5个σ键 | |
| C. | 气体单质中,一定有σ键,可能有π键 | |
| D. | 两种原子间形成共价键时,最多有一个σ键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | 相关信息 |
| A | A原子的1S轨道上只有1个电子 |
| B | B是电负性最大的元素 |
| C | C的基态原子2P轨道中有三个未成对电子 |
| D | D是主族元素且与E同周期,其最外层上有两个运动状态不同的电子 |
| E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
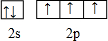
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 事实 | 结论 |
| A | 甲、乙两种有机物具有相同相对分子质量和不同结构 | 甲和乙一定是同分异构体 |
| B | 质量相同的甲、乙两种有机物完全燃烧时产生质量相同的水 | 甲、乙两种分子中,H原子个数一定相同 |
| C | 不存在两种二氯甲烷 | CCl2F2一定只有一种 |
| D | 一种烃在足量的氧气中燃烧并通过浓硫酸后气体体积减少 | 减少的体积就是生成水蒸气的体积 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com