
在容积不变的密闭容器中存在如下反应2SO2(g)+O2(g)⇌2SO3(g)△H<0,某研究小组探究其他条件下不变时,改变某一条件对上述反应的影响,下列分析正确的是( )
|
| A. | 图Ⅰ表示的是t1时刻增大O2的浓度对反应速率的影响 |
|
| B. | 图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
|
| C. | 图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙的高 |
|
| D. | 图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
| 化学反应速率的影响因素;化学平衡的影响因素. | |
| 专题: | 化学平衡专题. |
| 分析: | A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大; B.增大压强,正逆反应速率都增大,平衡发生移动,加入催化剂,正逆反应速率都增大,但速率相等,平衡不移动; C.加入催化剂,平衡不发生移动; D.增大压强,反应速率增大,平衡正向移动. |
| 解答: | 解:A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅰ应是增大压强的原因,故A错误; B.图Ⅱ在t0时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B正确; C.图III甲、乙两个平衡状态不同,而加入催化剂,平衡不发生移动,故C错误; D.增大压强,反应速率增大,平衡正向移动,SO2的转化率增大,故D错误. 故选B. |
| 点评: | 本题考查外界条件对化学反应速率、化学平衡的影响,题目难度中等,答题时注意: (1)若t0时刻无断点,则平衡移动肯定是改变某一物质的浓度导致. (2)若t0时刻有断点,则平衡移动可能是由于以下原因所导致:①同时不同程度地改变反应物(或生成物)的浓度; ②改变反应体系的压强;③改变反应体系的温度. (3)若平衡无移动,则可能是由于以下原因所导致:①反应前后气体分子个数不变;②使用了催化剂. (4)若V正在V逆的上方,即平衡向正反应方向移动;若V正在V逆的下方,即平衡向逆反应方向移动. |


科目:高中化学 来源: 题型:
某离子晶体中,晶体结构最小的重复单元如图:A为阴离子,在正方体内,B为阳离子,分别在顶点和面心,则该晶体的化学式为( )
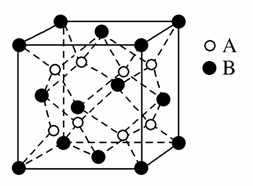
A.B2A B.BA2
C.B7A4 D.B4A7
查看答案和解析>>
科目:高中化学 来源: 题型:
用如图所示装置进行下列实验,实验结果与预测现象不一致的是

| 选项 | 中物质 | ②中物质 | 预测①中现象 |
| A | 酚酞溶液 | 浓氨水 | 无色变红色 |
| B | 湿润红布条 | 饱和氯水 | 红布条褪色 |
| C | 淀粉KI溶液 | 浓硝酸 | 无明显变化 |
| D | 硝酸银溶液 | 浓盐酸 | 有白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)⇌xC(g)△H=﹣192kJ•mol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )

|
| A. | 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N) |
|
| B. | 若x>3,达到平衡后B的转化率关系为:α(M)>α(N) |
|
| C. | 若x<3,C的平衡浓度关系为:c(M)>c(N) |
|
| D. | x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定条件下发生反应:2A(g)+2B(g)⇌xC(g)+2D(g),在2L密闭容器中,把4molA和2molB混合,2min后达到平衡时生成1.6molC,又测得反应速率VD=0.2mol/(L•min),下列说法正确的是( )
|
| A. | A和B的转化率均是20% |
|
| B. | x=4 |
|
| C. | 平衡时A的物质的量为2.8mol |
|
| D. | 平衡时气体压强比原来减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25℃、101kPa下,稀的强酸与强碱溶液反应的中和热为57.3kJ/mol.
(1)写出表示稀硫酸与稀烧碱溶液发生反应的中和热的热化学方程: .
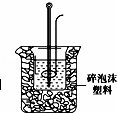
(2)学生甲用稀硫酸与稀烧碱溶液测定中和热装置如图.
①实验时所需的玻璃仪器除烧杯、量筒外还需: .
②该装置中有一处错误是: ,如果用该错误
装置测定,结果会 (填“偏高”“偏低”“无影响”)
③如果该生用50mL 0.25mol/L的稀硫酸与50mL 0.55mol/L的稀烧碱溶液,他用试剂的用量的理由是: .在该实验中需要测定某种数据,完成一次实验,需要测定该数据的次数为 次.使用正确的装置进行实验,取上述溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃.已知中和后生成的溶液的比热容为4.18J/(g•℃),溶液的密度均为1g/cm3.通过计算可得中和热△H= .
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下面三个数据:①7.2×10-4 ②4.6×10-4 ③4.9×10-10,分别是三种酸的电离平衡常数,若已知这些酸可发生如下反应:NaCN+HNO2===HCN+NaNO2;NaCN+HF===HCN+NaF;NaNO2+HF===HNO2+NaF。由此可判断下列叙述中,正确的是( )
A.HF的电离平衡常数是①
B.HNO2的电离平衡常数是①
C.HCN的电离平衡常数是②
D.HNO2的电离平衡常数是③
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关σ键的说法错误的是( )
A.如果电子云图象是由两个s电子重叠形成的,即形成ss σ键
B.s电子与p电子可形成sp σ键
C.p电子与p电子不能形成σ键
D.HCl分子里含一个sp σ键
查看答案和解析>>
科目:高中化学 来源: 题型:
配位化学创始人维尔纳发现,将各为1 mol的CoCl3·6NH3(黄色)、CoCl3·5NH3(紫红色)、CoCl3·4NH3(绿色)、CoCl3·4NH3(紫色)四种配合物溶于水,加入足量硝酸银溶液,立即沉淀的氯化银分别为3 mol、2 mol、1 mol、和1 mol。已知上述配合物中配离子的配位数均为6。
(1)请根据实验事实用配合物的形式写出它们的化学式。
CoCl3·6NH3______________________,
CoCl3·5NH3____________________,
CoCl3·4NH3(绿色和紫色)____________。
(2)后两种物质组成相同而颜色不同的原因是它们互为同分异构体,已知绿色的配合物内界结构对称,请在下图中用元素符号标出氯原子的位置。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com