
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构如图所示,电池总反
应可表示为2H2+O2=2H2O,下列有关说法正确的是( )
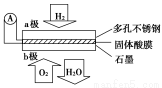
A.电子通过外电路从b极流向a极
B.b极上的电极反应式为O2+2H2O+4e-=4OH-
C.每转移0.1 mol电子,消耗1.12 L的H2
D.H+由a极通过固体酸电解质传递到b极
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源:2014年高考化学二轮复习专题滚动练4 化学实验练习卷(解析版) 题型:选择题
下列物质的除杂方法中,合理的是( )
①C2H6中混有的C2H4,可以将混合气体先通过溴水,然后用碱石灰干燥
②K2CO3中混有的少量NaHCO3,可以用加热的方法除去
③乙烯中混有的SO2气体可以通过酸性高锰酸钾溶液除去
④金属铜中含有的少量银和锌可以通过电解精炼的方法除去
⑤H2S中混有的水蒸气用浓硫酸干燥即可
A.①④ B.②③ C.①⑤ D.④⑤
查看答案和解析>>
科目:高中化学 来源:2014年高考化学二轮复习专题滚动练1 化学基本概念练习卷(解析版) 题型:选择题
实验室中制备乙烯的方法是使乙醇脱水,反应可以简单地表示为CH3CH2OH―→CH2=CH2↑+H2O。已知CH2=CH2(g)和C2H5OH(l)的燃烧热分别是1 411.0 kJ·mol-1和1 366.8 kJ·mol-1。则实验室用C2H5OH(l)制备CH2=CH2(g)生成1 mol液态水的ΔH为( )
A.-44.2 kJ·mol-1
B.+44.2 kJ·mol-1
C.-2 777.8 kJ·mol-1
D.+2 777.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
近年来,全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
A.太阳能、地热能、生物质能和核聚变能均属于“新能源”
B.“低碳”是指采用含碳量低的烃类作为燃料
C.下图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:选择题
下列叙述中,正确的是( )
A.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液鉴别
B.聚乙烯可发生加成反应
C.所有的糖类、油脂和蛋白质都能发生水解反应
D.符合分子式C5H12的物质有4种
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷二(解析版) 题型:填空题
化学学科中的化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理。请回答下列问题:
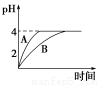
(1)常温下,取pH=2的盐酸和醋酸溶液各100 mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化如图所示。则图中表示醋酸溶液中pH变化曲线的是________(填“A”或“B”)。设盐酸中参加反应的Zn粒质量为m1,醋酸溶液中参加反应的Zn粒质量为m2,则m1________m2(选填“<”、“=”或“>”)。
(2)已知常温下Cu(OH)2的Ksp=2×10-20。又知常温下某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于________;要使0.2 mol·L-1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加NaOH溶液,使溶液pH为________。
(3)10 ℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
温度/℃ | 10 | 20 | 30 | 加热煮沸后冷却到50 ℃ |
pH | 8.3 | 8.4 | 8.5 | 8.8 |
在分析该溶液pH增大的原因时,甲同学认为是升高温度HCO3-的水解程度增大所致;乙同学认为是溶液中升高温度NaHCO3受热分解生成Na2CO3,CO32-水解程度大于HCO3-所致。请你设计一个简单的实验方案给甲和乙两位同学的说法以评判(包括操作、现象和结论)________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:填空题
A、B、C、D、E为五种原子序数依次增大的短周期主族元素。已知B的最外层电子数
与核外电子总数之比为3∶4;D的最外层电子数与次外层电子数之比为3∶4;E-、C+、A+的半径逐渐减小;常温下化合物AE为气体。
请回答下列问题:
(1)D、E的最高价氧化物对应水化物酸性较强的是________(写化学式)。
(2)用惰性电极电解化合物CE的饱和溶液,当电路中有0.2 mol电子通过时两极产生的气体在标准状况下的体积共________L。
(3)A与B、A与D均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:________。
(4)化合物乙、丙均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,乙溶液中水的电离程度比纯水的小。则化合物乙中的化学键类型为________;若丙为常见家用消毒剂的主要成分,则丙的化学式是________。
(5)均由A、B、C、D四种元素组成的两种盐发生反应的离子方程式是________;其中一种是强酸对应的酸式盐,写出向Ba(OH)2溶液中逐滴加入该盐溶液至中性发生反应的离子方程式:________。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后训练专题练习卷一(解析版) 题型:选择题
将a L NH3通过灼热的装有铁触媒的硬质玻璃管后,气体体积变为
b L(气体体积均在同温同压下测定),该b L气体中NH3的体积分数是( )
A.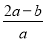 ×100% B.
×100% B.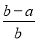 ×100%
×100%
C.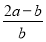 ×100% D.
×100% D. ×100%
×100%
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-4练习卷(解析版) 题型:选择题
已知298 K时,Mg(OH)2的溶度积常数Ksp=5.6×10-12,取适量的MgCl2溶液,加入一
定量的烧碱溶液达到沉淀溶解平衡,测得pH=13,则下列说法不正确的是( )
A.所得溶液中的c(H+)=1.0×10-13 mol·L-1
B.所得溶液中由水电离产生的c(OH-)=1.0×10-13 mol·L-1
C.所加的烧碱溶液的pH=13.0
D.所得溶液中的c(Mg2+)=5.6×10-10 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com