
下列物质属于天然高分子化合物的是( )
|
| A. | 蛋白质. | B. | 醋酸 | C. | 聚乙烯 | D. | 葡萄糖 |
科目:高中化学 来源: 题型:
在智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘,其化学方程式是:2NaIO3+5NaHSO3=3NaHSO4+2NaSO4+I2+H2O
(1)反应中 元素被氧化, 是氧化剂.
(2)反应产物中,氧化产物与还原产物的物质的量之比为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下用甲烷可以消除氮氧化物(NOx)的污染.已知:
①CH4( g )+4NO2( g )═4NO( g )+CO2( g )+2H2O( g )△H=﹣574kJ•mol﹣1
②CH4( g )+4NO( g )═2N2( g )+CO2( g )+2H2O( g )△H=﹣1160kJ•mol﹣1.
下列正确的选项是( )
|
| A. | CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(l)△H=﹣867kJ•mol﹣1 |
|
| B. | CH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子总数为3.2mol |
|
| C. | 若0.2mol CH4还原NO2至N2,在上述条件下放出的热量为173.4kJ |
|
| D. | 若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总数为3.2mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
分析如图所示的四个原电池装置,结论正确的是( )
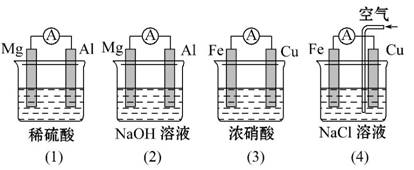
A.(1)(2)中Mg作负极,(3)(4)中Fe作负极
B.(2)中Mg作正极,电极反应式为6H2O+6e-====6OH-+3H2↑
C.(3)中Fe作负极,电极反应式为Fe-2e-====Fe2+
D.(4)中Cu作正极,电极反应式为2H++2e-====H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,装置(Ⅰ)是一种可充电电池的示意图,装置(Ⅱ)为电解池的示意图;装置(Ⅰ)的离子交换膜只允许Na+通过。电池充、放电的化学方程式为2Na2S2+NaBr3 Na2S4+3NaBr
Na2S4+3NaBr
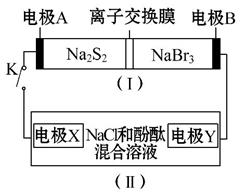
当闭合K时,X极附近溶液先变红色。下列说法中正确的是 ( )
A.装置(Ⅰ)中Na+从右到左通过离子交换膜
B.A电极的电极反应式为NaBr3+2Na++2e-====3NaBr
C.X电极的电极反应式为2Cl--2e-====Cl2↑
D.每有0.1 mol Na+通过离子交换膜,X电极上就放出标准状况下的气体1.12 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是( )
|
| A. | 稀硝酸与氢氧化钾溶液反应:H++OH一═H2O |
|
| B. | 铝与稀盐酸反应:Al+2H+═Al3++H2↑ |
|
| C. | 三氯化铁溶液与氢氧化钠溶液反应:FeCl3+3OH一═Fe(OH)3↓+3Cl﹣ |
|
| D. | 二氧化碳与石灰水反应:CO2+2OH一═CO32一+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
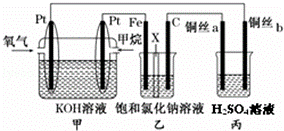
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜. 请按要求回答相关问题:
(1)甲烷燃料电池正极反应式为 .
(2)石墨电极(C)的电极反应式为 .
(3)若在标准状况下,有2.24 L氧气参加反应,则乙装置中铁电极上生成的气体体积为 L.
(4)丙中两根铜丝电极的质量均为64g,电解质为500mL 0.1mol•L﹣1H2SO4溶液.电解一段时间后,a端收集到1.12L气体(标准状况下),取出电极,对电极进行干燥并称重,测得b电极的质量减少6.4g.求此时所得溶液的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素Q、R、T、W在元素周期表中的位置如图所示,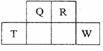 其中T所处的周期序数与主族序数相等。
其中T所处的周期序数与主族序数相等。
(1)T的原子结构示意图是_______。用化学方程式表示冶炼T单质常用原理是________。
(2)与同主族的某元素,其氢氧化物分子含有18个电子,该分子中存在的共价键的类型是___________。
(3)元素的非金属性:Q___W(填“强于”或“弱于”),用方程式简述其理由______。
(4)甲是R的氧化物,通常状况下呈红棕色。现有一试管甲,欲使元素R全部转化为其最高价氧化物对应水化物。实验步骤:将盛有甲的试管倒扣在水槽中,____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com