
NA表示阿伏加德罗常数,下列叙述正确的是
A.lmol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L0.5 mol • L-1硫酸钾溶液中阴离子所带电 荷数为NA
荷数为NA
C.1 mo l Na2O2固体中含离子总数为4NA
l Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体 中氢原子的个数为6 NA
中氢原子的个数为6 NA
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
(1)已知某反应的平衡常数表达式为:K=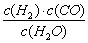 ,则它所对应反应的化学方程式是 ▲ 。
,则它所对应反应的化学方程式是 ▲ 。
(2) 合成甲醇的主要反应是:2H2(g)+CO(g)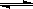 CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
CH3OH(g) △H=-90.8 kJ·mol-1,t℃下此反应的平衡常数为160。此温度下,在密闭容器中开始只加入CO、H2,反应l0min后测得各组分的浓度如下:
| 物质 | H2 | CO | CH3OH |
| 浓度(mol/L) | 0.2 | 0.1 | 0.4 |
(A)该时间段内反应速率v(H2)= ▲
(B)比较此时正、逆反应速率的大小:v正 ▲ v逆(填“>”、“<”或“=”)
(C)反应达到平衡后,保持其它条件不变,若只把容器的体积缩小一半,平衡向 ▲
(填“逆向”、“正向”或“不”)移动,平衡常数K ▲ (填“增大”、“减小” 或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
某工厂废水中含游离态氯,通过下列实验测定其浓度。①取水样10.0ml于锥形瓶中,加入10.0ml的K I溶液(足量),发生的反应为:Cl2+2KI=2KCl+I2,滴入指示剂2~3滴。②取一滴定管依次用自来水、蒸馏水洗净后,马上注入0.01mol·L-1Na2S2O3溶液,调整液面,记下读数。③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+ 2Na2S4O6 试回答下列问答:
⑴步骤①加入的指示剂是 。
⑵步骤②应使用 式滴定管。
⑶判断达到滴定终点的实验现象是 ;
⑷氯的实际浓度比所测浓度会偏小,造成误差的原因是
(5)用0.1032mol/L HCl溶液滴定未知浓度的NaOH溶液,下列情况对实验结果无影响的是
A、酸式滴定管未用标准盐酸溶液润洗 B、锥形瓶未用待测液润洗
C、滴定前滴定管尖嘴中有一气泡,滴定后气泡消失了
D、滴定时将标准液溅出锥形瓶外
查看答案和解析>>
科目:高中化学 来源: 题型:
将总物质的量为n mol的钠和铝的混合物(其中钠的物质的量分数为x),投入一定量的水中充分反应,金属没有剩余,共收集到标准状况下的气体V L 。下列关系式中正确的是 ( )
。下列关系式中正确的是 ( )
A.x=V/(11.2n) B.0<x≤0.5
C.V=33.6n(1-x) D.11.2n<V≤22.4n
查看答案和解析>>
科目:高中化学 来源: 题型:
室温时,M(OH)2(S)  M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
M2+(aq)+2OH-(aq) Ksp=a,c(M2+)=b mol·L-1时,溶液的pH等于( )
A. 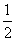 lg(
lg(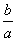 ) B.
) B. 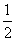 lg(
lg(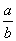 )
)
C.14+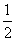 lg(
lg(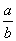 ) D.14+
) D.14+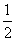 lg(
lg(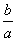 )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
标准状况下,一个装满氯气的容器的质量为74.6 g,若装满氮气时总质量为66 g,则此容器的容积是 ( )
A.22.4 L B.44.8 L
C.11.2 L D.4.48 L
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语以及化学基本概念的表述中正确的一组是( )
A. 过氧乙酸(CH3COOOH)与羟基乙酸(HOCH2COOH)所含官能团相同,两者互为同分异构体
B. 日本福岛核电站泄露的放射性核素Ⅰ和Cs,前者比后者少4个中子
C. 亚硫酸氢钠和碳酸氢钠的电离方程式都表示为NaHRO3⇋Na++HRO(R=C或S)
D. 次氯酸的结构式为HOCl,过氧化氢的电子式为H+[O O]2-H+
查看答案和解析>>
科目:高中化学 来源: 题型:
世界环保联盟建议全面禁止使用氯气用于饮用水的消毒,而建议采用高效“绿色”消毒剂二氧化氯。二氧化氯是一种极易爆炸的强氧化性气体,易溶于水、不稳定、呈黄绿色,在生产和使用时必须尽量用稀有气体进行稀释,同时需要避免光照、震动或加热。实验室以电解法制备ClO2的流程如下:
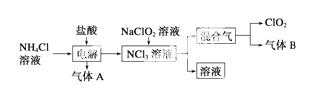
(1)ClO2中所有原子________(填“是”或“不是”)都满足8电子结构。上图所示电解法制得的产物中杂质气体B能使石蕊试液显蓝色,除去杂质气体可选用________。
A.饱和食盐水 B.碱石灰
C.浓硫酸 D.蒸馏水
(2)稳定性二氧化氯是为推广二氧化氯而开发的新型产品,下列说法正确的是________。
A.二氧化氯可广泛用于工业和饮用水处理
B.应用在食品工业中能有效地延长食品贮藏期
C.稳定性二氧化氯的出现大大增加了二氧化氯的使用范围
D.在工作区和成品储藏室内,要有通风装置和监测及警报装置
(3)欧洲国家主要采用氯酸钠氧化浓盐酸制备。化学反应方程式为________________________________________________________________。
缺点主要是产率低、产品难以分离,还可能污染环境。
(4)我国广泛采用经干燥空气稀释的氯气与固体亚氯酸钠(NaClO2)反应制备,化学方程式是________________________________________________________________________
________________________________________________________________________,
此法相比欧洲方法的优点是______________________________________________。
(5)科学家又研究出了一种新的制备方法,利用硫酸酸化的草酸(H2C2O4)溶液还原氯酸钠,化学反应方程式为_________________________________________________________
________________________________________________________________________。
此法提高了生产及储存、运输的安全性,原因是________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com