
分析 电解质和非电解质都必须是化合物;电解质在熔融状态或水溶液中能导电的化合物,非电解质是在熔融状态和水溶液中都不能导电的化合物,金属单质能导电;电解质在熔融状态或水溶液中能导电;据此即可解答.
解答 解:①Na是金属单质,既不是电解质也不是非电解质,但能导电;
②NaCl溶液是混合物,既不是电解质,也不是非电解质,但能导电;
③Na2O是金属氧化物,在熔融状态下能导电,所以是电解质,固体不能导电;
④蔗糖是在熔融状态和水溶液中都不能导电的化合物,是非电解质,不能导电;
⑤CO2溶液导电是由于二氧化碳和水反应生成了碳酸的缘故,是非电解质,本身不能够导电;
⑥Ba(OH)2是在熔融状态或水溶液中能导电的化合物,是电解质,固体不导电;
⑦乙醇 是在熔融状态和水溶液中都不能导电的化合物,是非电解质,不能导电;
⑧NaCl是电解质,固体不能导电;
⑨HCl气体是电解质,但气体本身不能够导电;
⑩K2SO4是电解质,固体不能导电;
故答案为:③⑥⑧⑨⑩;④⑤⑦;①②.
点评 本题考查了电解质与非电解质、物质的导电性判断,题目难度不大,注意明确电解质与非电解质的本质区别,明确溶液导电性原因.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
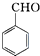 +KOH→
+KOH→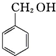 +
+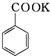
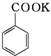 +HCl→
+HCl→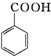 +KCl
+KCl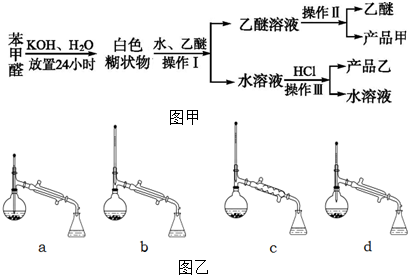
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
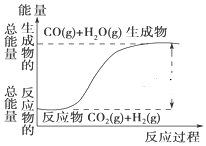
| A. | 其热化学方程式为:CO(g)+H2O(g)=CO2(g)+H2(g)△H=41kJ•mol-1 | |
| B. | 该反应为吸热反应 | |
| C. | 该反应为放热反应 | |
| D. | 当H2O为液态时,其反应热值大于41kJ•mol-1. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
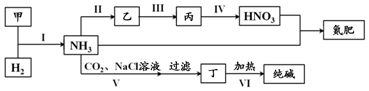
| A. | 甲、乙、丙三种物质中都含有氮元素 | |
| B. | 反应II、III和Ⅳ的氧化剂相同 | |
| C. | VI的产物可在上述流程中被再次利用 | |
| D. | V中发生反应:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去铁粉中混有少量铝粉,可加入过量的氢氧化钠溶液,完全反应后过滤 | |
| B. | 光照氯水有气泡冒出,该气体主要为Cl2 | |
| C. | 制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水中 | |
| D. | Na[Al(OH)4]溶液和盐酸可以通过相互滴加的方法来鉴别,NaHCO3溶液和Ca(OH)2溶液也可以通过相互滴加的方法来鉴别 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知CaO+H2O═Ca(OH)2放出大量的热,故可把该反应设计成原电池 | |
| B. | 因为铁的活泼性强于铜,所以将铁、铜用导线连接后放入浓硝酸中,若能组成原电池,必是铁做负极、铜做正极 | |
| C. | 理论上说,任何能自发进行的氧化还原反应都可设计成原电池 | |
| D. | 某原电池反应为Cu+2AgNO3═Cu(NO3)2+2Ag,装置中的盐桥内可以是含琼脂的KCl饱和溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | △H<0且△S>0的反应肯定是不自发的 | B. | △H<0且△S<0的反应肯定是自发的 | ||
| C. | △H>0且△S>0的反应肯定是自发的 | D. | △H<0且△S>0的反应肯定是自发的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4g金属镁变为镁离子时失去的电子数为0.1NA | |
| B. | 1.8g的NH4+离子中含有的电子数为NA | |
| C. | 53g碳酸钠中含NA个CO32- | |
| D. | 同温同压下,相同体积的任何气体单质所含的原子数相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com