
| A.产物中硝酸铜的物质的量为0.025 mol |
| B.若混合物中Cu的物质的量为0.005 mol,则其中Cu2O、CuO的物质的量共0.020 mol |
| C.若混合物中含0.01 mol Cu,则其中Cu2O、CuO的物质的量均为0.005 mol |
| D.混合物中Cu的物质的量的取值范围为0.005 mol<n(Cu)<0.015 mol |
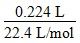 ÷2)=0.025 mol,故A正确。若混合物中Cu的物质的量为0.005 mol,设Cu2O和CuO的物质的量分别为x mol、y mol,则0.005+2x+y=0.025(铜元素守恒),0.005×2+2x=0.01×3(电子守恒),解得x=0.01,y=0,故B错误。同理可得C正确。设混合物中Cu的物质的量为z mol,则z+2x+y=0.025,2z+2x=0.03,两式相减得z=y+0.005,据此有z>0.005;又由2z+2x=0.03推得z=0.015-x,据此有z<0.015,故有0.015>z>0.005,故D正确。
÷2)=0.025 mol,故A正确。若混合物中Cu的物质的量为0.005 mol,设Cu2O和CuO的物质的量分别为x mol、y mol,则0.005+2x+y=0.025(铜元素守恒),0.005×2+2x=0.01×3(电子守恒),解得x=0.01,y=0,故B错误。同理可得C正确。设混合物中Cu的物质的量为z mol,则z+2x+y=0.025,2z+2x=0.03,两式相减得z=y+0.005,据此有z>0.005;又由2z+2x=0.03推得z=0.015-x,据此有z<0.015,故有0.015>z>0.005,故D正确。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 陈述 | 判断 |
| A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
| B | 在未知溶液中加入稀硝酸和氯化钡溶液有沉淀生成 | 说明该未知溶液含有SO42- |
| C | 铁、铜、汞、银的金属活动性顺序为Fe>(H)>Cu>Hg>Ag | 要从矿石中冶炼得到金属单质,铁和铜必须用还原剂,汞和银只需加热 |
| D | 锌锰干电池碳棒是正极,MnO2是氧化剂 | 锌锰干电池是二次电池,可以反复充电 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 步骤 | 操作 | 现象 |
| Ⅰ | 向2mL 1 mol·L-1FeCl3溶液中加入一定量的Na2SO3溶液 | 溶液由棕黄色变为红褐色,并有少量刺激性气味的气体逸出 |
| 步骤 | 操作 | 现象 |
| Ⅱ | 用激光笔照射步骤I中的红褐色溶液 | 出现“丁达尔效应” |
| 步骤 | 操作 | 现象 |
| Ⅲ | 向1 mol?L-1的FeCl3溶液中通入一定量的SO2 | 溶液由黄色变为红褐色 |
| Ⅳ | 用激光笔照射步骤Ⅲ中的红褐色溶液 | 没有出现“丁达尔效应” |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.铜和铁与FeCl3溶液构成的原电池中:Cu +2 Fe3+ = Cu2+ + 2Fe2+ |
| B.铁上镀锌时阴极析出6.5g锌,溶液中减少Zn2+数为0.1mol |
| C.在反应:4CuS + 5O2 = 2Cu2O + 4SO2中CuS既是氧化剂又是还原剂 |
| D.生铁与浓H2SO4加热反应可产生SO2和CO2气体 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
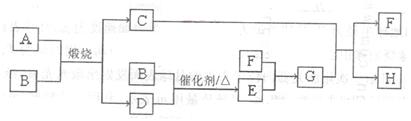
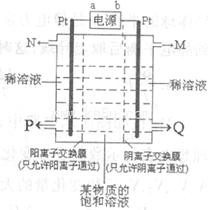
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
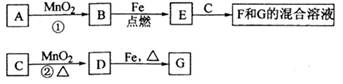
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.前者基本没有改变、后者变棕黄色 |
| B.前者变棕黄色、后者也变棕黄色 |
| C.前者变棕黄色、后者基本没有改变 |
| D.前者、后者都基本没有改变 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
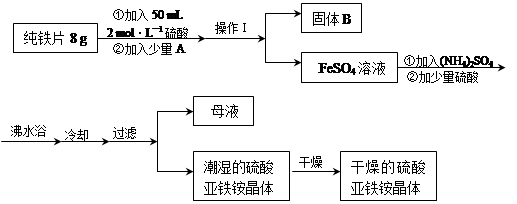
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com