
| 选项 | 现象或反应 | 原理解释 |
| A | KI淀粉溶液中滴入氯水变蓝,再通入SO2,蓝色褪去 | SO2具有漂白性 |
| B | 合成氨反应需在高温条件下进行 | 该反应为吸热反应 |
| C | 蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| D | 2CO=2C+O2在任何条件下均不能自发进行 | 该反应△H>0,△S<0 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.氯气和碘离子反应生成碘,碘遇淀粉试液变蓝色,二氧化硫能还原碘生成碘离子;
B.合成氨的反应是放热反应;
C.蒸馏时,温度计测定馏分温度;
D.如果△G=△H-T△S<0时,该反应能自发进行,否则不能自发进行.
解答 解:A.氯气和碘离子反应生成碘,碘遇淀粉试液变蓝色,二氧化硫能还原碘生成碘离子导致溶液褪色,该反应中二氧化硫体现还原性而不是漂白性,故A错误;
B.合成氨的反应是放热反应,需要高温是加快反应速率缩短反应时间,故B错误;
C.蒸馏时,温度计测定馏分温度,所以蒸馏时,温度计的球泡应靠近蒸馏烧瓶支管口处,此位置指示的是被蒸馏物质的沸点,故C正确;
D.如果△G=△H-T△S<0时,该反应能自发进行,否则不能自发进行,如果2CO=2C+O2在任何条件下均不能自发进行,则只要△G=△H-T△S>0即可,但该反应中不一定是△H>0、△S<0,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及元素化合物性质、反应热、实验操作等知识点,明确实验原理、物质性质、仪器用途等知识点是解本题关键,注意二氧化硫漂白性和还原性区别,题目难度不大.


科目:高中化学 来源: 题型:推断题
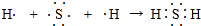 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
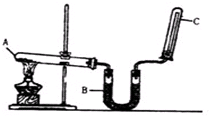 实验室通常用如图所示的装置来制取干燥的氨气.回答下列问题:
实验室通常用如图所示的装置来制取干燥的氨气.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
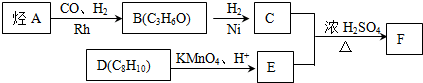

 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe$→_{点燃}^{O_{2}}$Fe2O3$\stackrel{H_{2}SO_{4}}{→}$Fe2(SO4)3 | |
| B. | 饱和食盐水$\stackrel{NH_{3}、CO_{2}}{→}$NaHCO3$\stackrel{△}{→}$Na2CO3 | |
| C. | 海水$\stackrel{熟石灰}{→}$Mg(OH)2$\stackrel{△}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | Cu2(OH)2CO3$\stackrel{H_{2}SO_{4}}{→}$CuSO4(aq)$\stackrel{Na}{→}$Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
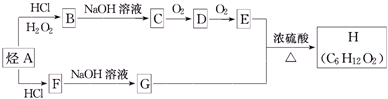
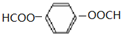
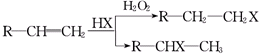 (X为卤素原子)
(X为卤素原子)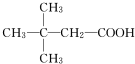 (用结构简式表示).
(用结构简式表示).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com