
【题目】CO2是目前最主要的温室气体,减小CO2的排放并用来制造有价值的化学用品是目前的研究目标。
(1)利用CO2与CH4生产合成气(CO、H2):
已知:CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3 KJ·mol-1
CO2(g)+2H2O(g) ΔH=-890.3 KJ·mol-1
CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=+2.8 KJ·mol-1
CO2(g)+H2(g) ΔH=+2.8 KJ·mol-1
2CO(g)+O2(g)![]() 2CO2(g) ΔH=-566.0 KJ·mol-1
2CO2(g) ΔH=-566.0 KJ·mol-1
反应CO2(g)+CH4(g)![]() 2CO(g)+2H2(g) ΔH= ____________。
2CO(g)+2H2(g) ΔH= ____________。
②250℃时,以镍合金为催化剂,向体积为4 L的密闭容器中通入6 mol CO2、6 mol CH4,开始发生如下反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g)。经过一段时间达到平衡,平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
2CO(g)+2H2(g)。经过一段时间达到平衡,平衡体系中各组分体积分数(某一成分物质的量占总气体物质的量的百分数)如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=________________。
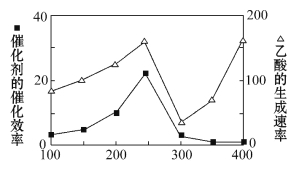
(2)以二氧化钛表面覆盖Cu2Al2O4为催化剂,可以将CO2和CH4直接转化成乙酸。在不同温度下催化剂的催化效率与乙酸的生成速率如下图所示。250~300℃时,乙酸的生成速率减小的可能原因是____________________。
(3) 如以氢氧化钾水溶液作电解质进行电解,CO2在铜电极上可转化为甲烷,该电极反应方程式为_____________________。
(4)将2mol CO2和6molH2容积相同而温度不同的Ⅰ、Ⅱ两个恒容密闭容器中开始发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如下图1所示。
CH3OH(g)+H2O(g),测得CH3OH的物质的量随时间的变化如下图1所示。

①曲线Ⅰ、Ⅱ对应的平衡常数大小关系为KⅠ_______KⅡ(填“>”“=”或“<”),可知该 反应是一个_______(填“放热”或“吸热”)反应。
②下列事实说明该反应已达到平衡状态的是_________________:
A.容器内气体压强保持不变
B.容器内气体的密度保持不变
C.CO2的体积分数保持不变
D.CO2的消耗速率与CH3OH的生成速率相等
E.容器内混合气体的平均相对分子质量保持不变
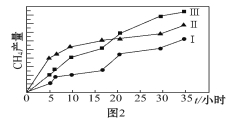
(5)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外光照射时,在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下,CH4产量随光照时间的变化如上图2所示。在0~15小时内,CH4的平均生成速率Ⅰ、Ⅱ和Ⅲ从大到小的顺序为_____________(填序号)。
【答案】(1)①+247.3KJ/mol;②64;
(2)250~300℃时催化剂的催化效率急剧降低;
(3)CO2+6H2O=8e-=CH4+8OH-;
(4)①>,放热;②ACE;
(5)Ⅱ>Ⅲ>Ⅰ。
【解析】
试题分析:(1)①CH4(g)+2O2(g) CO2(g)+2H2O(g),
②CO(g)+H2O(g) CO2(g)+H2(g),
③2CO(g)+O2(g)=2CO2(g),得出①+2×②-2×③
△H=(-890.3+2×2.8+2×566)kJ·mol-1= +247.3kJ·mol-1;
②CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)
2CO(g)+2H2(g)
起始: 6 6 0 0
变化: x x 2x 2x
平衡:6-x 6-x 2x 2x
根据体积分数,求出x=4,达到平衡时c(CO2)=2/4mol·L-1=0.5mol·L-1,c(CH4)=0.5mol·L-1,c(CO)=c(H2)=2mol·L-1,根据化学平衡常数的表达式,K=c2(H2)×c2(CO)/[c(CO2)×c(CH4)]=24/(0.5×0.5)= 64;(2)根据图像,250~300℃时催化剂的催化效率急剧降低;(3)CO2→CH4,化合价降低,得到电子,环境是碱性,因此电极反应式为CO2+6H2O=8e-=CH4+8OH-;(4)①先平衡,说明反应速率快,即II的温度大于I的温度,随着温度升高,CH3OH的物质的量降低,说明平衡向逆反应方向进行,正反应是放热反应,化学平衡常数只受温度的影响,即KI>KII;②A、反应前后气体系数之和不相等,因此压强不变,说明反应达到平衡,故正确;B、根据密度的定义,组分都是气体,因此气体质量不变,容器是恒容状态,气体体积不变,因此密度不变,不能说明反应达到平衡,故错误;C、根据化学平衡状态的定义,CO2的体积分数不变,说明反应达到平衡,故正确;D、用不同物质的反应速率表示达到平衡,要求反应方向一正一逆,且反应速率之比等于化学计量数之比,CO2的消耗速率和CH3OH的生成速率都是向正反应方向进行,因此不能判断平衡,故错误;E、根据M=m/n,组分都是气体,气体质量不变,反应前后气体系数之和不变,n不变时,说明反应达到平衡,故正确;(5)根据图像,单位时间内,CH4的产率变化大,说明生成速率快,即Ⅱ>Ⅲ>Ⅰ。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】
Ⅰ.酸碱中和滴定——已知某NaOH试样中含有NaCl杂质,为测定试样中NaOH的质量分数,进行如下步骤实验:
①称量1.00g样品溶于水,配成250 mL溶液;
②准确量取25.00mL所配溶液于锥形瓶中;
③ 滴加几滴酚酞溶液;
④用0.10mol/L的标准盐酸滴定三次,每次消耗盐酸的体积记录如下:
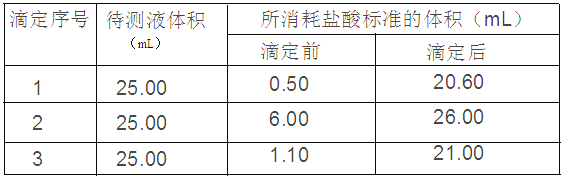
(1)用___________滴定管(填“酸式”或“碱式”)盛装0.10mol/L的盐酸标准液。
(2)试样中NaOH的质量分数为______________________。
(3)若出现下列情况,测定结果偏高的是___________。
a.滴定前用蒸馏水冲洗锥形瓶
b.在振荡锥形瓶时不慎将瓶内溶液溅出
c.若在滴定过程中不慎将数滴酸液滴在锥形瓶外
d.酸式滴定管滴至终点对,俯视读数
e.酸式滴定管用蒸馏水洗后,未用标准液润洗
Ⅱ.氧化还原滴定—取草酸溶液置于锥形瓶中,加入适量稀硫酸,用浓度为0.1mol·L-1的高锰酸钾溶液滴定,发生的反应为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O。
(4)滴定时,KMnO4溶液应装在酸式滴定管中,滴定终点时滴定现象是________________。
Ⅲ.沉淀滴定――滴定剂和被滴定物的生成物比滴定剂与指示剂的生成物更难溶。
(5)参考下表中的数据,若用AgNO3滴定NaSCN溶液,可选用的指示剂是 (填选项字母)。
难溶物 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
Ksp | 1.77×10-10 | 5.35×10-13 | 1.21×10-16 | 1.12×10-12 | 1.0×10-12 |
A.NaCl B.NaBr C.NaCN D.Na2CrO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
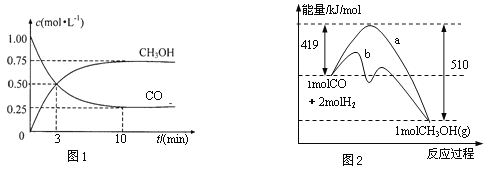
(1)图1是表示一定温度下,在体积为2 L的密闭容器中加入4 molH2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化情况。从反应开始到平衡,用CO浓度变化表示平均反应速率 v(CO)=_____________;H2的平衡转化率为_______________。
(2)图2表示该反应进行过程中能量的变化。曲线a表示不使用催化剂时反应的能量变化,曲线b表示使用催化剂后的能量变化。写出反应的热化学方程式:______________。
(3)该温度下,反应平衡常数K=______________(填数值)。
(4)恒容条件下,下列措施中能使反应体系中![]() 增大的措施有____________。
增大的措施有____________。
A.升高温度 B.充入He气 C.再充入2molH2 D.使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中互为同系物的是
A. 12C和13C
B. 甲酸和硬脂酸(C17H35COOH)
C. 乙二醇和甘油
D. 2,2-二甲基丙烷和新戊烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是
A.能与NaOH溶液反应的同分异构体共有6种
B.存在分子中含有六元环的同分异构体
C.既含有羟基又含有醛基的有5种
D.不存在含有2个羟基的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从对化合物分类方法出发,指出下列各组物质中与其他物质类型不同的一种物质。 a.Na2O、CaO、SO2、CuO。
b.NaCl、KCl、NaClO3、CaCl2。
c.HClO3、KClO3、HCl、NaClO3。
d.NaHCO3、Ca(HCO3)2、NH4HCO3、K2CO3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com