
| A. | 甲烷与乙烷体积比为1:4 | B. | 乙烯与丁烷体积比为4:1 | ||
| C. | 丙炔与乙炔物质的量比为4:1 | D. | 乙烯与丁烯物质的量比为1:4 |
分析 烃在氧气中充分燃烧的方程式为:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,由该方程式分析可知,温度在150℃时,当y=4时,该反应为等体积反应;当y<4时,反应为气体体积减小的反应;当y>4时,反应为气体体积增大的反应;容器内压强与气体的体积成正比,恢复到原温度时容器内压强为原来的108%,即:气体体积增大:(1+9)(108-100)%L=0.8L;甲烷、丙炔、乙烯分子中H原子均4,燃烧后气体体积不变,所以影响气体体积的关键是乙烷、丙炔、丁烷和丁烯,据此结合题中条件关系、烃的燃烧方程式进行计算即可.
解答 解:烃在氧气中充分燃烧的方程式为:CxHy+(x+$\frac{y}{4}$)O2→xCO2+$\frac{y}{2}$H2O,由该方程式分析可知,温度在150℃时,当y=4时,该反应为等体积反应;当y<4时,反应为气体体积减小的反应;当y>4时,反应为气体体积增大的反应,
在A、B、C、D四个选项中,甲烷、丙炔、乙烯分子中H原子均4,所以关键是分析乙烷、乙炔、丁烷、丁烯的反应情况,
恢复到原温度时容器内压强为原来的108%,即反应后容器内压强增大8%,即气体体积增大:(1+9)8%L=0.8L,
A.甲烷与乙烷体积比是1:4,乙烷的体积为0.8L,则
2C2H6+7O2→4CO2+6H2O 气体体积增大△V
2 7 4 6 1
0.8 0.4L,
气体体积增大了0.4L,不符合题意,故A错误;
B.2C4H10+13O2→8CO2+10H2O 气体体积增大△V
2 13 8 10 3
0.8L 1.2L,
气体体积增大了1.2L,不符合题意,故B错误;
C.乙炔分子中含有2个H,属于反应后气体体积减小的反应,故C错误;
D.C4H8+6O2→4CO2+4H2O 气体体积增大△V
1 6 4 4 1
0.8L 0.8L
反应后气体体积增大了0.8L,符合题意,故D正确;
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,注意掌握烃的燃烧通式在化学计算中的应用方法与技巧,试题侧重考查学生的分析、理解能力及化学计算能力.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题
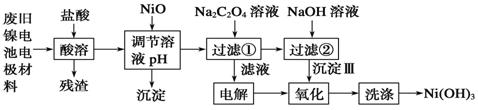
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质的还原性:W>X>Y | |
| B. | 原子半径:X>Y>Z>W | |
| C. | X的最高价氧化物对应水化物的碱性比Y的弱 | |
| D. | 化合物XYW4具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
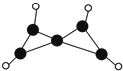 科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的结构如图所示(图中的连线表示化学键).下列说法不正确的是( )| A. | X在常温下不能稳定存在 | |
| B. | X的性质与烯烃类似,容易发生加成反应 | |
| C. | X不能使酸性KMnO4溶液褪色 | |
| D. | 充分燃烧等质量的X和甲烷,X消耗氧气比甲烷少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
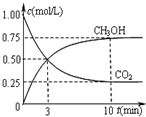 工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.
工业上可以以煤和水为原料通过一系列转化变为清洁能源氢气或工业原料甲醇.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
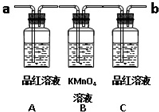 已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.
已知二氧化硫可使高锰酸钾溶液褪色,用如图装置(部分装置没画出)来验证某混合气体中同时含有SO2和CO2.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
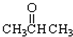 ③CH3CH2Br ④
③CH3CH2Br ④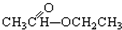 ⑤
⑤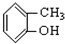 ⑥
⑥ ⑦
⑦ ⑧
⑧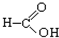 ⑨
⑨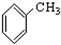 ⑩
⑩
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | W、M的离子半径及最高价氧化物对应水化物的碱性皆为M<W | |
| B. | YZ2为直线型的共价化合物,W2Z2既含有离子键又含有共价键 | |
| C. | Y与X形成的化合物的熔沸点一定低于Z与X形成的化合物的熔沸点 | |
| D. | Z与M形成的化合物可作为耐高温材料,W、M、X以1:1:4组成的化合物是应用前景很广泛的储氢材料,具有很强的还原性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容量瓶中原有少量蒸馏水 | |
| B. | 定容时观察液面俯视 | |
| C. | 滴管加水时,有少量水滴到容量瓶外 | |
| D. | 溶液从烧杯转移到容量瓶中后没有洗涤烧杯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com